题目内容
下列有关实验现象和解释或结论都正确的是
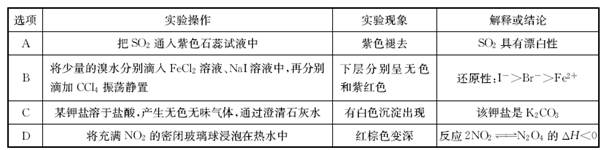

D
试题分析:A.把SO2通入到紫色石蕊试液中,由于SO2与水反应产生了H2SO3,溶液显酸性,所以溶液变为红色。这是酸性氧化物的性质。错误。B. 把少量的溴水滴入到FeCl2溶液中发生反应:2Fe2++Br2=Fe3++2Br-.,把少量的溴水滴入到NaI溶液中发生反应2I-+Br2=I2+2Br-。当再分别滴加CCl4时,由于卤素单质I2在CCl4中的溶解度比在水中的大,而水与四氯化碳又互不相溶。所以振荡并静止后,原来NaI溶液的下层为红色,而原来FeCl2的下层认为无色。这只能证明还原性Fe2+>Br-,I->Br-。至于Fe2+和I-的还原性那个更强,则不能说明。错误。C.某盐溶于盐酸,产生无色、无味的气体,该气体通入到澄清的石灰水中产生白色沉淀,就证明该气体为CO2,但能产生CO2气体的可能是碳酸盐也可能是碳酸氢盐。因此判断错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于该反应的正反应为放热反应,所以升高温度平衡向逆反应方向移动,产生了更多的红棕色的NO2气体,所以红棕色加深。正确。

练习册系列答案
相关题目
 无沉淀
无沉淀 白色沉淀
白色沉淀 气体
气体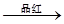 褪色
褪色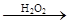 棕黄色溶液
棕黄色溶液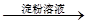 蓝色溶液
蓝色溶液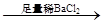 白色沉淀
白色沉淀 沉淀溶解
沉淀溶解

 H+ + OH-、HCO3-
H+ + OH-、HCO3-