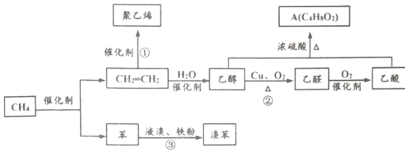
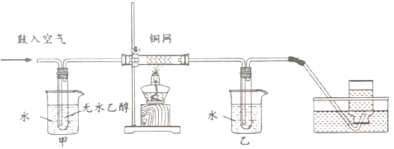
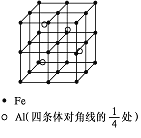
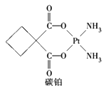
题目内容
【题目】Na2CO3是一种重要的化工原料,工业上生产Na2CO3的主要流程可表示如下:
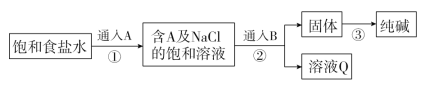
则下列说法中正确的是
A. A气体是CO2,B是NH3
B. ③中生成的CO2可循环使用,它可完全满足生产的需要
C. 通入B后的离子方程式为Na++NH3+CO2+H2O=NaHCO3↓+NH4+
D. 溶液Q的成分是NH4Cl,可通过降温结晶的方法使其析出
【答案】C
【解析】
联系工业制碱的原理可知,在饱和食盐水中首先通入氨气,再通入二氧化碳,反应生成碳酸氢钠沉淀和氯化铵溶液,碳酸氢钠分解即可得到碳酸钠,据此分析解答。
A.二氧化碳在水中的溶解度较小,氨气极易溶于水,因此A气体是NH3,B是CO2,故A错误;
B.②中反应需要消耗二氧化碳,③中碳酸氢钠分解又生成二氧化碳,因此③中生成的CO2可循环使用,②中需要的二氧化碳部分转化为碳酸钠,因此③中生成的CO2不能完全满足生产的需要,故B错误;
C.通入B后,氨气、氯化钠、二氧化碳和水反应生成了碳酸氢钠和氯化铵,反应的离子方程式为Na++NH3+CO2+H2O=NaHCO3↓+NH4+,故C正确;
D.溶液Q的主要成分是NH4Cl、氯化钠和碳酸氢钠,且为碳酸氢钠的饱和溶液,通过降温结晶,会析出碳酸氢钠固体,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目