题目内容
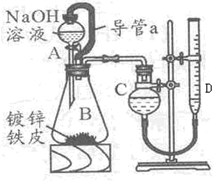
(12分)用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
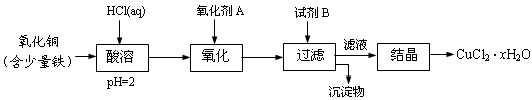
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2 ② KMnO4 ③ HNO3 ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO ④Cu2(OH)2CO3
(3)试剂B的作用是______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2 ② KMnO4 ③ HNO3 ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO ④Cu2(OH)2CO3
(3)试剂B的作用是______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。
(12分)(1) ①④(2分)
(2) ③④(2分)
(3) ①③ (2分)
(4) ②④①(2分)
(5)二(2分);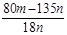 (2分)
(2分)
(2) ③④(2分)
(3) ①③ (2分)
(4) ②④①(2分)
(5)二(2分);
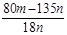 (2分)
(2分)试题分析:(1)四种试剂都具有强氧化性,为的是制取氯化铜晶体,选用的氧化剂反应后不能生成其它杂质离子,因此选用① Cl2 ④ H2O2。(2)试剂B与氧化剂A选择条件是相似的,因此选用③ CuO④Cu2(OH)2CO3。(3)选择的试剂B,通过与酸的反应生成Cu2+且提高溶液的pH。因在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。所以促使了Fe3+完全沉淀。(4)氯化铜晶体的生成,对滤液先加热蒸发使水份减少溶液浓缩,再冷却结晶,过滤就得到了氯化铜晶体。(5)氯化铜晶体灼烧的温度足以分解氯化铜,氯化铜经过灼烧是不能以氯化铜的形式存在的,会分解为CuO,CuCl2+2H2O
 Cu(OH)2+2HCl Cu(OH)2
Cu(OH)2+2HCl Cu(OH)2 CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:
CuO + H20,固体不可能为纯净的CuCl2,因此第一种方法不正确。第二方案中,最终生成的是CuO,根据铜原子守恒可得:CuCl2?xH2O → CuO
135+18x 80
m n
(135+18x)/m = 80/n
x=(80m-135n)/18n
点评:解答本题找准考点是关键,考查了盐类水解,注意方案一中最终的固体不可能为纯净的CuCl2。

练习册系列答案
相关题目

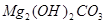 、
、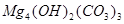 、
、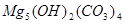 等。请你设计一个测定碱式碳酸镁组成的实验方案。包括
等。请你设计一个测定碱式碳酸镁组成的实验方案。包括