题目内容
【题目】节日期间因燃放鞭炮会引起空气中SO2含量增高,造成大气污染。某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答问题:
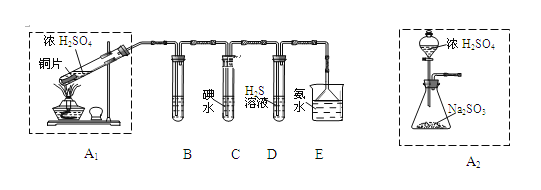
①装置A1中发生反应的化学方程式为_______;
②装置B用于检验SO2的漂白性,其中所盛试剂为_____,装置D用于检验SO2的_______性质;
③装置C中反应的离子方程式为_____;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,你认为装置A2的优点是(写一点即可)_____________________;
(2)他们拟用以下方法测定空气中SO2含量(假设空气中无其他还原性气体、实验在标准状况下测定)。
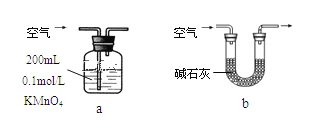
你认为哪个装置可行(填序号)______,使用你所选用的装置测定SO2含量时,还需要测定的物理量是_____________________________;
【答案】Cu+2H2SO4(浓) ![]() CuSO4+2H2O+SO2↑ 品红溶液 氧化性 SO2+I2+2H2O=SO42-+2I-+4H+ 不用加热(或节约能源、节约药品或易于控制反应进行,反应更充分) a 当KMnO4溶液刚褪色时,测定通入空气的体积V
CuSO4+2H2O+SO2↑ 品红溶液 氧化性 SO2+I2+2H2O=SO42-+2I-+4H+ 不用加热(或节约能源、节约药品或易于控制反应进行,反应更充分) a 当KMnO4溶液刚褪色时,测定通入空气的体积V
【解析】
(1)①装置A1中Cu与浓硫酸共热发生反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
②SO2有漂白性,在装置B用品红溶液检验二氧化硫;二氧化硫与硫化氢发生反应SO2+2H2S=3S↓+H2O,反应中SO2是氧化剂,表现氧化性;
③装置C中SO2与碘水发生反应I2+SO2+2H2O=H2SO4+2HI,据此写出反应的离子方程式;
④使用装置A2的优点是不用加热,可以节约能源,相对安全,易于控制反应进行,反应更充分等;
(2)二氧化硫能够被酸性KMnO4溶液氧化,可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。
(1)①在装置A1中Cu与浓硫酸共热发生反应生成硫酸铜、二氧化硫气体和水,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
②装置B用于检验SO2的漂白性,SO2能与某些有色物质如品红结合形成无色的物质,因此SO2有漂白性,在装置B用品红溶液检验;在装置D中发生反应:SO2+2H2S=3S↓+H2O,反应中SO2是氧化剂,表现氧化性,H2S是还原剂,表现还原性;
③在装置C中SO2与碘水发生反应:I2+SO2+2H2O=H2SO4+2HI,反应的离子方程式为:SO2+I2+2H2O=SO42-+2I-+4H+;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1,使用装置A2的优点是不用加热,可以节约能源,相对安全;易于控制反应进行;反应更充分等;
(2)①将含有SO2的空气通入到KMnO4溶液中,只有SO2能发生反应,所以可以测定空气中SO2含量;若使用这种方法只需测定当KMnO4溶液刚褪色时,测定通入空气的体积V即可。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案