题目内容
含有1mol HNO3的稀硝酸分别与不同物质的量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是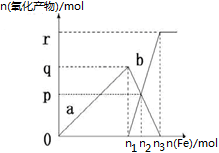
| A.a是Fe(NO3)2 | B.n1=0.375 | C.p=0.20 | D.n2=0.30 |
D
解析试题分析:向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,故AB错误;C选项,Fe(NO3)3与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe="3" Fe(NO3)2,P点为 Fe(NO3)3与 Fe(NO3)2物质的量相等的点,设生成的 Fe(NO3)2物质的量xmol,则利用方程式可求得x=0.15,即P=0.15,故C错误;D选项,再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)3),所以 n(Fe)=0.3mol即n2=0.3mol,故D正确。
考点:化学方程式的有关计算

 阅读快车系列答案
阅读快车系列答案用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A.1 mol NH3中含有中子数为7NA个 |
| B.标准状况下,11.2 L H2O含有的分子数为0.5NA |
| C.2 g氢气所含质子数是NA |
| D.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
下列变化属于物理变化的是
| A.煤的液化 | B.原子核裂变 | C.石油裂化 | D.木材的干馏 |
下列有关化学用语的表示,正确的是
A.质子数为92,中子数为146的U原子: |
B.CCl4分子的比例模型: |
| C.甲醛与醋酸的最简式相同 |
D.2-甲基丁醇的结构简式: |
设NA为阿伏加德罗常数的值,下列说法正确的组合是 ( )
a 12 g 金刚石中含有的碳碳键的数目为2NA
b 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
e 标准状况下,2.24 L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下,100mL 1mol ? L-1 AlCl3溶液中阳离子总数大于0.1NA
| A.a c f h | B.a c e g | C.a c e f h | D.b d e h |
下列说法正确的是( )
| A.1molO的质量是16g/mol | B.Na+ 的摩尔质量是23g/mol |
| C.CO2的摩尔质量是44 | D.氢的摩尔质量是2g/mol |
下列有关气体体积的叙述中,正确的是( )
| A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定 |
| B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定 |
| C.不同的气体,若体积不同,则它们所含的分子数也不同 |
| D.气体摩尔体积指1mol任何气体所占的体积约为22.4L. |
在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为
| A.0.15 mol/L | B.0.20 mol/L |
| C.0.25 mol/L | D.0.40 mol/L |