题目内容
1. 按如图所示装置进行下列不同的操作,其中不正确的是( )
按如图所示装置进行下列不同的操作,其中不正确的是( )| A. | 铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 | |
| B. | 只接通K1,一段时间后,U形管中出现白色沉淀 | |
| C. | 只接通K2,U形管左、右两端液面均下降 | |
| D. | 先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |
分析 A.铁腐蚀的速度由大到小的顺序是:作电解池阳极>原电池负极>不形成电池>电解池阴极;
B.只接通K1,该装置是电解池,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应,根据生成的离子之间是否反应判断现象;
C.只接通K2,阳极上氯离子放电,阴极上氢离子放电,都生成气体,根据气体压强的变化判断液面变化;
D.先只接通K1,阳极上铁放电,阴极上氢离子放电,只接通K2,阳极上氯离子放电,阴极上氢离子放电,根据气体压强的变化判断反应现象.
解答 解:A.只接通K1时,该装置是电解池,铁作阳极,腐蚀最快,只闭合K3时,该装置构成原电池,铁作负极发生吸氧腐蚀,腐蚀较快,只闭合K2时,该装置构成电解池,铁作阴极而被保护,所以铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2,故A正确;
B.只接通K1,该装置是电解池,阳极上铁失电子生成亚铁离子,阴极上氢离子放电,同时阴极附近生成氢氧根离子,亚铁离子和氢氧根离子反应生成灰白色氢氧化亚铁沉淀,所以一段时间后,U形管中出现白色沉淀,故B正确;
C.只接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,故C正确;
D.只接通K1,阴极上氢离子放电生成氢气导致U型管右端液面下降,则漏斗内液面上升,接通K2,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,所以左右两端都有气体生成,压强增大导致U型管液面均下降,漏斗内液面上升,故D错误;
故选D.
点评 本题考查了原电池和电解池原理,难度较大,注意:如果电解池的阳极材料是活泼电极,则电解池工作时,阳极材料放电而不是电解质溶液中的阴离子放电,为易错点.

练习册系列答案
相关题目
12.燃烧10g CH4生成液态水和气态CO2,放出556.5kJ的热量,以下的热化学方程式正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=55.65kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.65kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.4kJ/mol | |
| D. | CH4(g)+2O2═CO2+2H2O△H=890.4kJ/mol |
9.由CO2、CO和H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、CO和H2的体积比为( )
| A. | 29:13:8 | B. | 13:29:8 | C. | 22:14:1 | D. | 26:57:15 |
16.下列叙述正确的是( )
| A. | CO2的水溶液可以导电,CO2是电解质 | |
| B. | 硫酸钡难溶于水,但却是电解质 | |
| C. | 氯化钠溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |
6.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
13.下列说法正确的是( )
| A. | 氯水要现用现制,并保存在盖有橡胶塞的棕色瓶子中,置于冷暗处 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此一定不能与酸溶液发生反应 |
10.下列各组离子在溶液中能大量共存的是( )
| A. | NH4+、SO42-、NO3- | B. | Ba2+、SO42-、NO3- | C. | Na+、H+、HCO3- | D. | NH4+、OH-、Cl- |
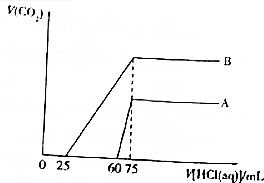 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.