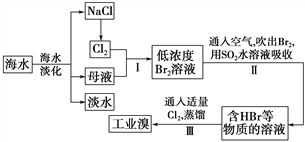
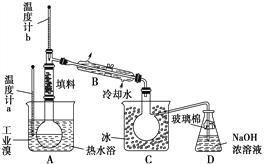
题目内容
【题目】取一定量CuO粉末与0.5L稀硫酸充分反应后,将一根50g铁棒插入上述溶液中,至铁棒质量不再变化时,铁棒增重0.24g,并收集到224mL H2(标准状况).由此推知CuO粉末的质量为( )
A.1.92g
B.2.4g
C.6.4g
D.8g
【答案】D
【解析】解:氧化铜能与硫酸反应生成硫酸铜和水,生成的硫酸铜能与铁反应生成硫酸亚铁和铜,生成的铜附着在铁的表面,铁能与硫酸反应生成氢气,设生成0.02g氢气需要铁的质量为x则有
Fe+ | H2SO4═FeSO4+ | H2↑ |
56 | 2 | |
x | 0.02g |
![]() =
= ![]() ,解得:x=0.56g,
,解得:x=0.56g,
与硫酸铜反应的铁的质量为50g﹣0.56g=49.44g,反应后铁棒的质量为50.24g,说明铁与硫酸铜反应时增重的质量为50.24g﹣49.44g=0.8g,设硫酸铜的质量为y,根据反应的化学方程式则有
Fe+ | CuSO4 | ═FeSO4+ | Cu | △m |
56 | 160 | 64 | 64﹣56=8 | |
y | 0.8g |
![]() =
= ![]() ,解得y=16g,
,解得y=16g,
设氧化铜的质量为z.则有
CuO + | H2SO4═ | CuSO4+H2O |
80 | 160 | |
z | 16g |
![]() =
= ![]() ,解得z=8g,
,解得z=8g,
故选D.

【题目】元素周期表是指导我们系统学习化学的重要工具。下表是元素周期表的一部分:
C | N | O | F |
Si | P | S | Cl |
Br | |||
I |
(1)元素周期表中每种元素的具体信息如图例示。从中可以获得氟元素的有关信息有(任意写出1点)_________________________________________。
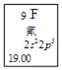
(2)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的______相同。N和P处于同一列,因为它们的________相同,它们都位于元素周期表的第______族。
(3)通过元素周期表,我们可以知道:
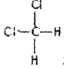
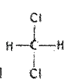
①氮元素的最低化合价为___________,其气态氢化物的电子式为_________________。
②原子半径:r(P)_________r(S)(填“>”、“<”或“=”)。
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是_________(写化学式).