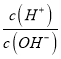题目内容
【题目】如图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
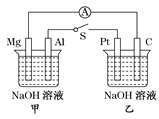
A. 电流表指针不发生偏转 B. Al、Pt两极有H2产生
C. 甲池pH增大,乙池pH减小 D. Mg、C两极生成的气体在一定条件下可以恰好完全反应
【答案】D
【解析】分析:铝能与氢氧化钠溶液反应,甲是原电池,Al是负极,Mg是正极,乙是电解池,石墨电极是阳极,氢氧根放电,Pt电极是阴极,氢原子放电,据此解答。
详解:铝能与氢氧化钠溶液反应,因此甲是原电池,Al是负极,Mg是正极,负极:Al + 4OH- -3e-=AlO2- +2H2O,正极:2H+ + 2e-=H2↑,总反应式:2Al +2NaOH +2H2O=2NaAlO2+3H2↑。乙装置是电解池,其中Pt是阴极:2H2O + 2e-=H2↑ + 2OH-,C是阳极:4OH- - 4e-=2H2O + O2↑,总反应式:2H2O![]() 2H2↑ + O2↑。则
2H2↑ + O2↑。则
A、左边是原电池,右边是电解池,电流表指针发生偏转,A错误;
B、Al是负极,没有H2产生;Mg是正极,产生H2,B错误;
C、乙是电解水,水减少,NaOH浓度增大,pH增大,甲中消耗氢氧化钠,pH减小,C错误;
D、Mg、C两极正好产生H2和O2,且体积比是2:1,一定条件下可恰好完全反应生成水,D正确。答案选D。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目