题目内容
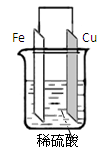
(6分)(1) 将铁片和铜片用导线连接并插入足量的CuSO4溶液中,当导线上有0.2mol电子通过时,从理论上分析铁片和铜片的质量变化(写出计算过程);
(2) 将(1)的反应中的铜片和导线去掉,也能发生反应,同样发生0.2mol电子转移时,铁片上的质量又如何变化?(简要地写出计算过程)
(2) 将(1)的反应中的铜片和导线去掉,也能发生反应,同样发生0.2mol电子转移时,铁片上的质量又如何变化?(简要地写出计算过程)
(1)铁片质量减少5.6g,铜片质量增加6.4g
(2)铁片增重0.8g
(2)铁片增重0.8g
考查原电池的有关计算。在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以铁是负极,铜是正极,溶液中的铜离子得到电子而形成铜。如果不用导线相连,则铁直接和硫酸铜发生置换反应。
(1)铁比铜活泼,铁是负极,铜是正极,电极反应式分别是
Fe - 2e- = Fe2+ 、 Cu2+ + 2e- = Cu
56g 2mol 2mol 64g
5.6g 0.2mol 0.2mol 6.4g
即铁片质量减少5.6g,铜片质量增加6.4g
(2)去掉导线,则发生反应
Fe+CuSO4=FeSO4+Cu ~e- ~△m↑
56g 64 2mol 8g
0.2mol 0.8g
即铁片增重0.8g。
(1)铁比铜活泼,铁是负极,铜是正极,电极反应式分别是
Fe - 2e- = Fe2+ 、 Cu2+ + 2e- = Cu
56g 2mol 2mol 64g
5.6g 0.2mol 0.2mol 6.4g
即铁片质量减少5.6g,铜片质量增加6.4g
(2)去掉导线,则发生反应
Fe+CuSO4=FeSO4+Cu ~e- ~△m↑
56g 64 2mol 8g
0.2mol 0.8g
即铁片增重0.8g。

练习册系列答案
相关题目

 +7H2O
+7H2O
 CO2+2H2O
CO2+2H2O