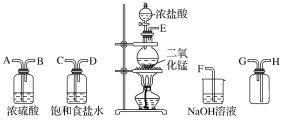
题目内容
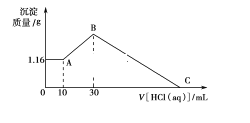
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
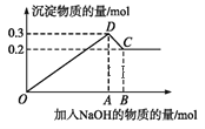
(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点横坐标为_______ 。
(4)图中线段OA∶AB=____________。
【答案】Al3++3OH- === Al(OH)3↓ Mg2++ 2OH- === Mg(OH)2↓ Al(OH)3+ OH- === AlO2- +2H2O 2∶1 0.8 7∶1
【解析】
由图像可知,AB段产生沉淀质量增大,发生的反应是Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,DC段沉淀质量减少,发生的反应是Al(OH)3+NaOH═NaAlO2+2H2O。
(1)OD段镁离子和铝离子全部转化为沉淀,其离子方程式为Al3++3OH- === Al(OH)3↓ Mg2++ 2OH- === Mg(OH)2↓;DC段NaOH过量时氢氧化铝溶解,其离子方程式为Al(OH)3+ OH-=== AlO2-+2H2O;
(2)由图象可知,0~A发生Al3++3OH- === Al(OH)3↓ 、 Mg2++ 2OH- === Mg(OH)2↓;,A~B发生Al(OH)3+ OH-=== AlO2-+2H2O, C点对应的沉淀为Mg(OH)2,D点对应的沉淀为Mg(OH)2和Al(OH)3,则Mg(OH)2的物质的量为0.2mol,Al(OH)3的物质的量为0.3mol-0.2mol=0.1mol,由元素守恒可知,原溶液中Mg2+、Al3+物质的量浓度之比为0.2mol:0.1mol=2:1;
(3)由Mg2++ 2OH-═Mg(OH)2↓
0.2mol 0.4mol
Al3+ + 3OH-═Al(OH)3↓
0.1mol 0.3mol
Al(OH)3+OH-═AlO2-+2H2O
0.1mol 0.1mol
则C点NaOH的物质的量为0.4mol+0.3mol+0.1mol=0.8mol;
(4)0~A发生Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓, A~B发生Al(OH)3+OH-═AlO2-+2H2O,则线段OA对应的NaOH的物质的量为0.4mol+0.3mol=0.7mol,线段AB对应的NaOH的物质的量为0.1mol,所以线段OA:AB=0.7mol:0.1mol=7:1。

【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7