题目内容
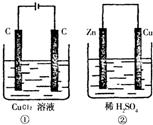 如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是( )
如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑气体的溶解和溶液体积的变化,则下列叙述中正确的是( )分析:A、根据转移电子的量可以计算①的阳极和②的正极产生气体的量;
B、①中的两个电极上均析出物质,②中只有正极析出物质,根据转移电子的量可以计算均析出物质的质量;
C、①相当于电解氯化铜本身,②相当于锌和硫酸中的氢离子反应;
D、原电池的负极是金属失电子的过程,电解池的阳极是惰性电极时,则阴离子在该极失电子.
B、①中的两个电极上均析出物质,②中只有正极析出物质,根据转移电子的量可以计算均析出物质的质量;
C、①相当于电解氯化铜本身,②相当于锌和硫酸中的氢离子反应;
D、原电池的负极是金属失电子的过程,电解池的阳极是惰性电极时,则阴离子在该极失电子.
解答:解:A、①的阳极反应:2Cl-=Cl2+2e-,导线中通过0.02mol电子时,产生氯气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的体积V=nVm=0.01mol×22.4L/mol=0.0224L,所以产生气体的体积:①=②,故A错误;
B、①的阳极反应:2Cl-=Cl2+2e-,导线中通过0.02mol电子时,产生氯气的质量m=nM=0.01mol×71g/mol=0.071g,阴极反应:Cu2++2e-=Cu,导线中通过0.02mol电子时,产生铜的质量m=nM=0.01mol×64g/mol=0.064g,所以①电极上析出物质的质量为0.071g+0.064g=0.135g,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的质量m=nM═nVm=0.01mol×2g/mol=0.02g,所以②电极上析出物质的质量为0.02g,①>②,故B正确;
C、①相当于电解氯化铜本身,溶液的pH不变,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C错误;
D、②中负极:Zn-2e-=Zn2+,①中阳极:2Cl-→Cl2+2e-,故D错误.
故选B.
B、①的阳极反应:2Cl-=Cl2+2e-,导线中通过0.02mol电子时,产生氯气的质量m=nM=0.01mol×71g/mol=0.071g,阴极反应:Cu2++2e-=Cu,导线中通过0.02mol电子时,产生铜的质量m=nM=0.01mol×64g/mol=0.064g,所以①电极上析出物质的质量为0.071g+0.064g=0.135g,②中的正极反应为:2H++2e-=H2↑,导线中通过0.02mol电子时,产生氢气的质量m=nM═nVm=0.01mol×2g/mol=0.02g,所以②电极上析出物质的质量为0.02g,①>②,故B正确;
C、①相当于电解氯化铜本身,溶液的pH不变,②相当于锌和硫酸中的氢离子反应,所以氢离子减少,酸性减弱,所以pH增大,故C错误;
D、②中负极:Zn-2e-=Zn2+,①中阳极:2Cl-→Cl2+2e-,故D错误.
故选B.
点评:本题是一道有关原电池和电解池的工作原理的综合题目,要求学生熟悉教材基本知识,具备分析和解决问题的能力.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目