题目内容
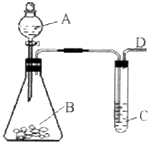 (2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.
(2009?福州一模)某同学用如图所示的装置来探究SO2的性质及有关实验.(1)实验前应先检验装置的气密性,方法是
用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气.
用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气.
(2)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出化学方程式
Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
.(3)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是
紫色溶液变为红色
紫色溶液变为红色
,继续通入过量的SO2气体,现象是红色不褪去(或溶液颜色无变化)
红色不褪去(或溶液颜色无变化)
.②若C溶液是橙色的溴水溶液,通入SO2气体后现象
溴水褪色
溴水褪色
,写出反应的离子方程式SO2+Br2+2H2O═4H++SO42-+2Br-
SO2+Br2+2H2O═4H++SO42-+2Br-
.③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是
首先有白色沉淀生成,然后白色沉淀消失
首先有白色沉淀生成,然后白色沉淀消失
.分析:(1)运用气体的体积热胀冷缩的原理检查装置的气密性;
(2)亚硫酸是弱酸,硫酸是强酸,利用强酸制弱酸的原理制取;
(3)①酸使紫色石蕊试液变红,二氧化硫不能漂白指示剂;
②二氧化硫与溴水发生氧化还原反应;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙.
(2)亚硫酸是弱酸,硫酸是强酸,利用强酸制弱酸的原理制取;
(3)①酸使紫色石蕊试液变红,二氧化硫不能漂白指示剂;
②二氧化硫与溴水发生氧化还原反应;
③二氧化硫通入到澄清石灰水中先生成亚硫酸钙沉淀,后沉淀溶解生成亚硫酸氢钙.
解答:解:(1)如果装置封闭,不漏气,用双手(或热毛巾)握住B时,相当于给装置中的气体加热,气体的体积热胀冷缩,C中有气泡产生,移开双手,温度降低,气体的体积缩小,C中导管形成一段水柱.故答案为:用双手(或热毛巾)握住B,C中有气泡产生,移开双手,C中导管形成一段水柱,说明不漏气;
(2)盐和酸反应生成新盐和新酸,该反应中生成的亚硫酸立即分解生成二氧化硫,故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.故答案为:紫色溶液变为红色 红色不褪去(或溶液颜色无变化);
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色.故答案为:溴水褪色 SO2+Br2+2H2O═4H++SO42-+2Br-;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2.故答案为:首先有白色沉淀生成,然后白色沉淀消失.
(2)盐和酸反应生成新盐和新酸,该反应中生成的亚硫酸立即分解生成二氧化硫,故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)①二氧化硫溶于水生成亚硫酸,亚硫酸使紫色溶液变为红色;二氧化硫虽有漂白性,但它不能使指示剂褪色.故答案为:紫色溶液变为红色 红色不褪去(或溶液颜色无变化);
②溴水与二氧化硫发生氧化还原反应,溴被二氧化硫中+4价的硫还原成-1价的溴,+4价的硫被溴氧化成+6价的硫,溴水褪色.故答案为:溴水褪色 SO2+Br2+2H2O═4H++SO42-+2Br-;
③二氧化硫通入到澄清石灰水中少量时反应为:SO2+Ca(OH)2=CaSO3↓+H2O,二氧化硫过量时:SO2+CaSO3+H2O=Ca(HSO3)2.故答案为:首先有白色沉淀生成,然后白色沉淀消失.
点评:该题主要考查了二氧化硫的制取以及二氧化硫漂白与被氧化的区别,解题时需从化合价角度分析漂白与被氧化的区别,才能正确解题.

练习册系列答案
相关题目
