题目内容
(11分)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
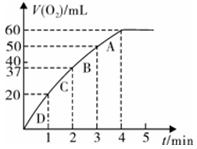
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为 min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。(2分)
⑥解释反应速率变化的原因 。(2分)
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)(2分)

①写出H2O2在二氧化锰作用下发生反应的化学方程式 。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为 min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。(2分)
⑥解释反应速率变化的原因 。(2分)
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)(2分)
①2H2O2
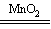 2H2O + O2↑;(2分)
2H2O + O2↑;(2分)②60 mL ; ③1 min ; (各1分)
④2.5 min;(1分) ⑤D>C>B>A;(2分)
⑥随着反应的进行,浓度减小,反应速率减慢 (2分)
⑦0.11 mol·L-1;(2分)
略

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
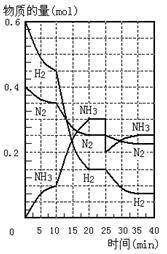
 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1 ,原因是
,原因是  N键、1mol H
N键、1mol H H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:946 kJ、436 kJ,则破坏1mol N ΔH1=+67.7 kJ/mol
ΔH1=+67.7 kJ/mol B+C,②500 K时,D
B+C,②500 K时,D
 N2O4(g) 正反应为放热反应。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是( )
N2O4(g) 正反应为放热反应。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如右图。下列说法正确的是( )
 2CO(g) 能加快反
2CO(g) 能加快反