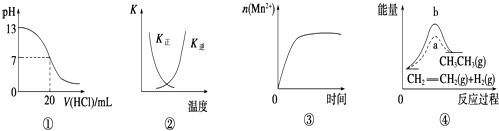
��Ŀ����
����Ŀ���������һ����Ҫ�ķǽ������ϣ��Ʊ��������Ҫ��������:
�ٸ�������̼��ԭ���������Ƶôֹ�
�ڴֹ������HCl���巴Ӧ�Ƶ�SiHCl3: Si+3HC1![]() SiHCl3+H2
SiHCl3+H2
��SiHCl3�����H2��1000��1100�淴Ӧ�Ƶô��衣��֪SiHCl3����H2Oǿ�ҷ�Ӧ���ڿ���������ȼ��
��ش���������:
(1)������ȡ�ֹ�Ļ�ѧ����ʽ:_____________________��
(2)�ֹ���HCl ��Ӧ��ȫ�������õ���SiHCl3 (�е�33.0��) �к�������SiCl4(�е�57.6��)��HCl(�е�-84.7��)���ᴿSiHCl3���õķ���Ϊ______________��
(3)��SiHCl3�����H2��Ӧ�Ʊ������װ������(��Դ���г�װ����ȥ)��
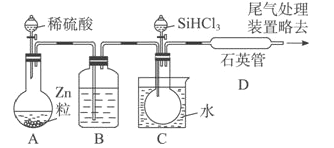
��װ��B�е��Լ���Ũ���ᡣװ��C �е���ƿ��Ҫ���ȣ���Ŀ����____________��
��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ____________��
��Ϊ������Ʒ�����Ƿ��������ʣ���������ϡ�����ܽ⣬ȡ�ϲ���Һ�����ټ�����Լ�(��д��ĸ����)��____________��
a.��ˮ b.��ˮ c.NaOH��Һ d.KSCN ��Һ e.Na2SO3
���𰸡� SiO2+2C![]() Si+2CO�� �������� ʹ������ƿ�е�SiHCl3���� SiHCl3+H2
Si+2CO�� �������� ʹ������ƿ�е�SiHCl3���� SiHCl3+H2![]() Si+3HCl b��d
Si+3HCl b��d
��������������������⿼��ֹ���Ʊ����ᴿ��Fe2+�ļ��飬��ѧ����ʽ����д��
��1����������̼��ԭSiO2����Si��CO����Ӧ�Ļ�ѧ����ʽΪ2C+SiO2![]() Si+2CO����
Si+2CO����
��2������SiHCl3����������SiCl4��HCl�ķе����ϴ���е㲻ͬ��Һ̬������÷������������ᴿSiHCl3���õķ���Ϊ����������
��3��װ��A��Zn��ϡ���ᷴӦ��ȡH2����Ӧ�Ļ�ѧ����ʽΪZn+H2SO4=ZnSO4+H2����
��װ��A���Ƶõ�H2�л���H2O��g����SiHCl3����ˮǿ�ҷ�Ӧ��װ��B��Ũ����������Ǹ���H2����������SiHCl3�����H2��1000~1100�淴Ӧ�Ƶô��裬SiHCl3�ķе�Ϊ33.0�棬װ��C�е���ƿ��Ҫ���ȵ�Ŀ����ʹ������ƿ�е�SiHCl3������
��װ��D��SiHCl3�����H2��Ӧ����Si��HCl����Ӧ�Ļ�ѧ����ʽΪSiHCl3+H2![]() Si+3HCl��
Si+3HCl��
����Ʒ�����������������ʣ�������ϡ�����ܽ���Fe��ϡ���ᷴӦ����FeCl2��H2��ֻҪ�����ϲ���Һ���Ƿ�Fe2+�����жϲ�Ʒ���Ƿ�������������Fe2+ѡ����ˮ��KSCN��Һ��ʵ�鷽��������������ϡ�����ܽ⣬ȡ�ϲ���Һ����KSCN��Һ���ټ�����ˮ������Һ��죬˵�������к�����������ط�ӦΪFe+2H+=Fe2++H2����Cl2+2Fe2+=2Fe3++2Cl-��Fe3++3SCN-=Fe��SCN��3����ѡb��d��

����Ŀ�������й�ʵ�����������ͽ��ͻ���۶���ȷ����
ѡ�� | ʵ����� | ���� | ���ͻ���� |
A | ������Fe���м���ϡHNO3����ַ�Ӧ����KSCN��Һ | ��Һ�ʺ�ɫ | ϡHNO3��Fe����ΪFe3+ |
B |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | ������.Cl2>Br2>I2 |
C | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
D | ŨHNO3���� | �к���ɫ���� | HNO3��ǿ������ |
A. A B. B C. C D. D