题目内容
11.为了保护环境,变害为利,工业上常用纯碱吸收有害气体SO2,同时得到亚硫酸氢钠,该反应的离子方程式是2H2SO3 +CO32-=2HSO3-+CO2↑.从这一反应可见H2SO3的酸性比H2CO3的酸性强.亚硫酸钠常用于除去漂白织物后剩余的游离氯,该反应的离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+.分析 H2SO3的酸性比H2CO3的酸性强,可发生2H2SO3 +CO32-=2HSO3-+CO2↑,亚硫酸钠具有还原性,可与氯气发生氧化还原反应,以此解答该题.
解答 解:纯碱吸收有害气体SO2,同时得到亚硫酸氢钠,反应的离子方程式为2H2SO3 +CO32-=2HSO3-+CO2↑,说明H2SO3的酸性比H2CO3的酸性强,亚硫酸钠具有还原性,可与氯气发生氧化还原反应,反应的离子方程式为SO32-+Cl2+H2O═SO42-+2Cl-+2H+,
故答案为:2H2SO3 +CO32-=2HSO3-+CO2↑;强;SO32-+Cl2+H2O═SO42-+2Cl-+2H+.
点评 本题考查了硫及其化合物性质,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关知识的积累.

练习册系列答案
相关题目
下表中评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | Fe3 2Fe3O4+18H+===6Fe3++H2↑+8H2O | 正确 |
B | 向碳酸镁中加入稀盐酸: CO | 错误,碳酸镁不应写成离子形式 |
C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO | 正确 |
D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1∶2 |
2.在一定温度下,一定量的水中,石灰乳悬浊液存在下列平衡:Ca(OH)2(s)?Ca(OH)2(aq)?Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法正确的是( )
| A. | n(Ca2+)减小 | B. | c(Ca2+)减小 | C. | n(OH-)增大 | D. | c(OH-)减小 |
19.常温下,将0.02mol•L-1的Ba(OH)2溶液 100mL 和0.02mol•L-1NaHSO4溶液 100mL混合,若忽略溶液体积变化,则混合后的溶液( )
| A. | pH=12 | |
| B. | pH=2 | |
| C. | 由水电离产生的[H+]=1.0×10-2mol•L-1 | |
| D. | 溶质的物质的量浓度为0.01 mol•L-1 |
6.常温下能用铁贮槽或铝贮槽盛装的是( )
| A. | 浓盐酸 | B. | 稀盐酸 | C. | 浓硫酸 | D. | 稀硫酸 |
16.对下列事实的解释正确的是( )
| A. | 浓硝酸在光照下变黄,说明浓硝酸不稳定,且生成的产物可溶于浓硝酸 | |
| B. | 向某溶液中加入氯化钡溶液和稀硝酸,有白色沉淀生成,说明该溶液中一定含有SO42- | |
| C. | 常温下,将铜放入浓硫酸中无明显变化,说明铜在冷浓硫酸中钝化 | |
| D. | 氯气使湿润的碘化钾淀粉试纸变蓝,说明氯气与淀粉反应 |
 O4与稀硝酸反应:
O4与稀硝酸反应: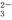 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O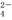 ===BaSO4↓
===BaSO4↓