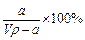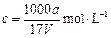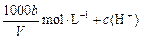题目内容
一定量的氢气在氯气中燃烧,所得混合物用100 mL3.00 mol/LNaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比v(Cl2):v(H2)= 。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比v(Cl2):v(H2)= 。
(1)10.7% (2)0.25 (3)3︰2
题给中没有给出氢气和氯气的具体量,但因为反应后的混合物与NaOH溶液反应有NaClO生成,这意味着在反应中氯气过量。混合物恰好被完全吸收后,最后所得的溶液为NaCl和NaClO的混合液。由Na、Cl的原子个数比为1︰1易求得答案。
(1)
 =10.7%。
=10.7%。
(2)据反应Cl2+H2=2HCl,Cl2+2NaOH=NaCl+NaClO+H2O,HCl+NaOH=NaCl+H2O
可知溶液中:n(Na+)=n(Cl-)+n(ClO-)=0.1 L×3.00mol·L-1=n(Cl-)+0.0500mol
n(C1-)="0.25" mol。
(3)利用相同条件下,体积比等于物质的量之比来求解。先根据NaClO的量确定与H2反应后过量的氯气的量,再根据NaCl与NaClO的差量确定氢气的量。
n(与H2反应后过量的Cl2)= n(NaClO)=" 0.0500" mol,
则n(H2)=n(与H2反应的Cl2)=(0.25-0.05)/2 ="0.1" mol
故:v(Cl2):v(H2)=(0.05+0.1)mol︰0.1 mol=3︰2
(1)

 =10.7%。
=10.7%。 (2)据反应Cl2+H2=2HCl,Cl2+2NaOH=NaCl+NaClO+H2O,HCl+NaOH=NaCl+H2O
可知溶液中:n(Na+)=n(Cl-)+n(ClO-)=0.1 L×3.00mol·L-1=n(Cl-)+0.0500mol
n(C1-)="0.25" mol。
(3)利用相同条件下,体积比等于物质的量之比来求解。先根据NaClO的量确定与H2反应后过量的氯气的量,再根据NaCl与NaClO的差量确定氢气的量。
n(与H2反应后过量的Cl2)= n(NaClO)=" 0.0500" mol,
则n(H2)=n(与H2反应的Cl2)=(0.25-0.05)/2 ="0.1" mol
故:v(Cl2):v(H2)=(0.05+0.1)mol︰0.1 mol=3︰2

练习册系列答案
相关题目