题目内容
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
B
试题分析:A、粗铜精炼是阳极首先活泼性强于铜的金属失去电子,所以电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数不一定为0.5NA,A不正确;B、CO2和N2O的相对分子质量相对,都是44,且都是3个原子构成的,因此4.4gCO2和N2O混合物中所含有的原子数为
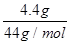 ×3×6.02×1023/mol=0.3×6.02×1023,B正确;C、等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,盐酸是过量的,反应后溶液中氢离子浓度=
×3×6.02×1023/mol=0.3×6.02×1023,B正确;C、等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,盐酸是过量的,反应后溶液中氢离子浓度=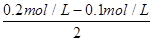 =0.05mol/L,因此pH不是1,C不正确;D、溶液中由水电离出的c(H+)=1×10-12mol/L,这说明溶液中水的电离平衡是被抑制的,因此溶液可能显酸性,与可能显碱性。如果显酸性,则NO3-能氧化Fe2+不能大量共存。如果显碱性,则Mg2+不能大量共存,D不正确,答案选B。
=0.05mol/L,因此pH不是1,C不正确;D、溶液中由水电离出的c(H+)=1×10-12mol/L,这说明溶液中水的电离平衡是被抑制的,因此溶液可能显酸性,与可能显碱性。如果显酸性,则NO3-能氧化Fe2+不能大量共存。如果显碱性,则Mg2+不能大量共存,D不正确,答案选B。
练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目

 ,该溶液中:
,该溶液中: