题目内容
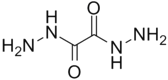
【题目】目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
A.SO2(氧化物)
B.碘酒(单质)
C.HNO3(含氧酸)
D.氯水(混合物)
【答案】B
【解析】A、是由氧元素和硫元素组成的化合物属于氧化物,A不符合题意;
B、碘酒是酒精和碘单质的混合物,不是单质,B符合题意;
C、硝酸属于含氧酸,C不符合题意;
D、氯水是氯气溶于水形成的混合物,D不符合题意;
故答案为:B.
A、两种元素组成其中一种为氧元素的化合物属于氧化物;B、碘酒是混合物;C、硝酸属于含氧酸;D、氯水是混合物。

 阅读快车系列答案
阅读快车系列答案【题目】(1)工业上尝试用太阳能分解水制取H2,其过程如下:
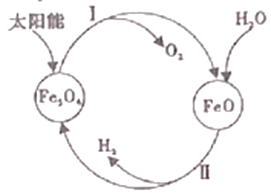
已知:2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ/mol
2Fe3O4(s)![]() 6FeO(s)+O2(g) △H=+313.8kJ/mol
6FeO(s)+O2(g) △H=+313.8kJ/mol
①过程I中,需将O2及时分离出去,目的是_________。
②过程II的热化学方释式是_________。
③整个过程中,Fe3O4的作用是_________。
(2)工业上利用H2合成氢的反应原理为:3H2(g)+N2(g) ![]() 2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
2NH3(g)。现有甲、乙两个容积为1L的密闭容器.在相同条件下,按不同的反应物投入量进行合成氢反应相关数据如下表示:
容器 | 甲 | 乙 |
反应物投入量 | 2molH2、2molN2 | 4malH2.4molN2 |
平衡时N2的浓度(mol/L) | c1=1.5 | c2 |
NH3的体积分数 | ω1 | ω2 |
混合气体的密度(g/L) | ρ1 | ρ2 |
①下列情况下,反应达到平衡状态的是_____(填序号)
a.3molH-H共价键断裂同时有6molN-H共价键形成
b.3v正(N2)=v逆(H2)
c.混合气体的平均相对分子质量保持不变
②反应的平衡常数K=_______(结果保留3位有效数字).
③分析上表中的数据,有以下关系:c2________3mol/L;ω1________ω2(填“>”、“<”、“=”);若ρ1=ag/L,则ρ2________g/L(用含a的式子表示)
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
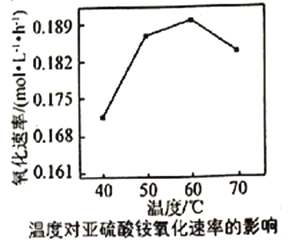
试解释在温度较高时,(NH4)2SO3氧化速率下降的原因是_________。
【题目】根据下列实验操作、现象,所得结论正确的是
实验操作 | 实验现象 | 实验结论 | |
A | 在盛番茄汤的玻璃杯中加入适量植物油,充分搅拌、静置 | 上层液体颜色比下层液体深 | 番茄色素在水中的溶解度比在植物油中的大 |
B | 向Na2SiO3溶液中加入1~2滴酚酞溶液,再逐渐滴入稀盐酸,边加边振荡 | 溶液红色变浅并接近消失时,有透明的凝胶产生 | 制得了硅酸胶体 |
C | 向盛有10mL水的锥形瓶中,小心滴入SOCl2液体 | 剧烈反应,液面有白雾形成,并有带刺激性气味的气体逸出,该气体能使品红溶液褪色 | SOCl2与水发生了氧化还原反应 |
D | 向滴有酚酞溶液的碳酸钠溶液中滴加足量氯化钡溶液 | 析出白色沉淀,溶液红色褪去 | 氯化钡溶液显酸性 |
A. A B. B C. C D. D
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
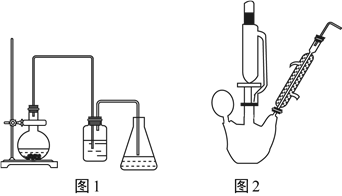
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
(1)请补充图1烧瓶中反应的化学方程式:
①2Fe+3Br2=2FeBr3 ②______________________________。
(2)图1洗气瓶中盛放的试剂为__________,实验中观察到洗气瓶 的液体变为橙黄色;还观察到锥形瓶中出现白雾,这是因为____________________形成的。
(3)制得的溴苯经过下列步骤进行提纯:
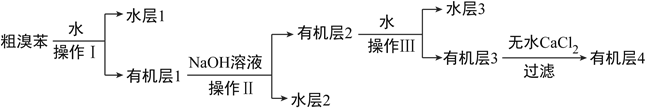
①操作Ⅰ、Ⅱ、Ⅲ中有机层在__________(填仪器名称)中处于__________层。
②操作Ⅱ中NaOH溶液的作用是____________________。
③向有机层3加入氯化钙的目的是______________________________。
④经以上操作后,要对有机层4进一步提纯,下列操作中必须的是__________(填选项)。
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)若使用图2所示装置制取溴苯,球形冷凝管中冷却水应由__________口进入,恒压滴液漏斗中盛放的试剂应为__________(填选项)。
a.苯 b.液溴