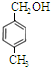
题目内容
20.下列有关说法正确的是( )| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 根据反应中HNO3(稀)$\stackrel{被还原}{→}$NO,而HNO3(浓)$\stackrel{被还原}{→}$NO2可知,氧化性HNO3(稀)>HNO3(浓) | |
| D. | 含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
分析 A、在Cl2+2NaOH═NaCl+NaClO+H2O的反应中,1molCl2参加反应转移电子数为NA;
B、在反应KIO3+6HI═KI+3I2+3H2O中,反应中元素化合价变化计算电子转移;
C、不能根据还原产物的价态确定氧化剂氧化性的强弱;
D、NO3-+H+具有强氧化性,能氧化Fe2+.
解答 解:A、在Cl2+2NaOH═NaCl+NaClO+H2O的反应中,1molCl2参加反应转移电子数为NA,故A错误;
B、在反应KIO3+6HI═KI+3I2+3H2O中,碘元素化合价+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,每生成3mol I2转移的电子数为5NA,故B错误;
C、不能根据还原产物的价态确定氧化剂氧化性的强弱,实际上氧化性:HNO3(浓)>HNO3(稀),故C错误;
D、NO3-+H+具有强氧化性,能氧化Fe2+,所以含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-,故D正确;
故答案为:D.
点评 本题考查了阿伏伽德罗常数的分析应用,氧化还原反应电子转移计算以及离子共存等,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
10.X,Y都是短周期元素,X原子的最外层上有4个电子,Y原子的最外层上有6个电子,则X与Y形成化合物的化学式可能为( )
| A. | XY2 | B. | X2Y4 | C. | YX2 | D. | XY |
11.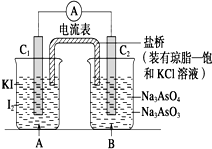 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
 已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置
已知反应AsO${\;}_{4}^{3-}$+2I-+2H+?AsO${\;}_{3}^{3-}$+I2+H2O是可逆反应.设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40%NaOH溶液
结果发现电流表指针均发生偏转.据此,下列判断正确的是( )
| A. | 操作Ⅰ过程中,C1为正极 | |
| B. | 操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 | |
| C. | Ⅰ操作过程中,C2棒上发生的反应为AsO${\;}_{4}^{3-}$+2H++2e-=AsO${\;}_{3}^{3-}$+H2O | |
| D. | Ⅱ操作过程中,C1棒上发生的反应为2I--2e-=I2 |
5.下列关于浓硫酸的叙述中,错误的是( )
| A. | 浓硫酸滴在纸上使纸变黑,是由于浓硫酸有脱水性 | |
| B. | 稀释浓硫酸时,应将水沿器壁慢慢注入浓硫酸中,并不断用玻璃棒搅拌 | |
| C. | 欲除去CO2中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶 | |
| D. | 不慎在皮肤上沾上少量浓硫酸时,应立即用大量水冲洗 |
12.下列纯净物中既能跟氢气反应,又能跟高锰酸钾溶液反应,但既不能跟溴水发生加成反应,又不能发生加聚反应的是( )
| A. | 裂化汽油 | B. | 直馏汽油 | C. | 甲苯 | D. | 苯 |
9.据图判断下列说法正确的是( )


| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
10.一定温度下,某密闭容器中发生如下反应:A(g)+B(g)?C(g)+D(g)△H<0.当反应达到平衡时测得容器中各种物质均为amol.欲使C的平衡浓度增大一倍,在其他条件不变时,下列措施可采用的是( )
| A. | 降低温度 | B. | 恒容时,再通入2amolC和2amolD | ||
| C. | 恒压时,再通入2amolC和2amolD | D. | 恒容时,再通入amolA和amolB |
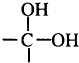 →
→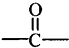 +H2O图中B和
+H2O图中B和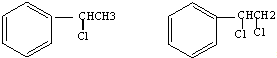 等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳(过程中一些小分子未写出).
等都是A和Cl2发生反应生成的产物,E是一种高分子化合物,透光性能好,常用作一些灯饰外壳(过程中一些小分子未写出).
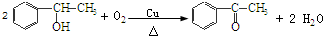 ’,该反应类型为氧化反应
’,该反应类型为氧化反应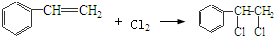 ,该反应类型为加成反应
,该反应类型为加成反应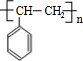
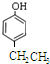 、
、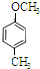 、
、