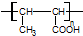题目内容
A、B、C、D分别代表四种不同的元素.A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子.
(1)C原子的电子排布式为 ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ;
(2)当n=2时,B的最高价氧化物的结构式是 ,B与C形成的晶体属于 晶体.当n=3时,B与C形成的晶体中,B原子的杂化方式为 ,该晶体中最小的环共有 个微粒构成,微粒间的作用力是 ;
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是
(用元素符号表示).
(1)C原子的电子排布式为
(2)当n=2时,B的最高价氧化物的结构式是
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是
分析:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有3个电子,则D元素原子电子排布式为1s22s22p6 3s23p3,故D为P元素;
(1)氧原子核外电子数为8,根据核外电子排布规律书写;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;根据氢键分析熔沸点;
(2)当n=2时,B为碳元素,其最高价氧化物二氧化碳中C原子与O原子之间形成2对共用电子对;碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,该晶体中最小的环相当于金刚石六元环中C原子换成Si原子,Si-Si之间插入1个O原子,碳原子与氧原子之间形成共价键;
(3)若A元素的原子最外层电子排布为4s1,则A为K元素,周期数=电子层数、族序数=最外层电子数;
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,注意N元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素.
(1)氧原子核外电子数为8,根据核外电子排布规律书写;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键;根据氢键分析熔沸点;
(2)当n=2时,B为碳元素,其最高价氧化物二氧化碳中C原子与O原子之间形成2对共用电子对;碳元素与氧元素生成的化合物为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,属于原子晶体,该晶体中最小的环相当于金刚石六元环中C原子换成Si原子,Si-Si之间插入1个O原子,碳原子与氧原子之间形成共价键;
(3)若A元素的原子最外层电子排布为4s1,则A为K元素,周期数=电子层数、族序数=最外层电子数;
B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,非金属性越强第一电离能越大,注意N元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素.
解答:解:A、B、C、D分别代表四种不同的短周期元素.A元素的原子最外层电子排布为ns1,A位于ⅠA族;B元素的原子价电子排布为ns2np2,B位于ⅣA族;C元素的最外层电子数是其电子层数的3倍,则C元素原子有2个电子层,最外层电子数为6,故C为氧元素;D元素原子的M电子层的P亚层中有3个电子,则D元素原子电子排布式为1s22s22p6 3s23p3,故D为P元素,
(1)氧原子核外电子数为8,核外电子排布为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,水分子之间存在氢键,熔沸点高于同主族其它元素氢化物沸点,
故答案为:1s22s22p4;σ;水分子间形成氢键;
(2)当n=2时,B为碳元素,其最高价氧化物为二氧化碳,结构式是O=C=O;碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,Si原子成4个Si-O键、不含孤对电子,Si原子采取sp3杂化,该晶体中最小的环相当于金刚石六元环中C原子换成Si原子,Si-Si之间插入O原子,故最小的环中含有6个Si原子、6个O原子,共有12个原子,二氧化硅晶体属于原子晶体,微粒间的作用力为共价键,
故答案为:O=C=O;分子;sp3;12;共价键;
(3)若A元素的原子最外层电子排布为4s1,则A为K元素,处于第四周期ⅠA族.B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,N元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:第四周期ⅠA族;O>P>Si>Li.
(1)氧原子核外电子数为8,核外电子排布为1s22s22p4;若A元素的原子最外层电子排布为1s1,则A为氢元素,与氧元素形成的化合物为水等,共价键为1s电子与2p电子成键,属于σ键,水分子之间存在氢键,熔沸点高于同主族其它元素氢化物沸点,
故答案为:1s22s22p4;σ;水分子间形成氢键;
(2)当n=2时,B为碳元素,其最高价氧化物为二氧化碳,结构式是O=C=O;碳元素与氧元素生成的化合物CO、二氧化碳都为分子晶体;
当n=3时,B为Si元素,与氧元素形成的化合物为二氧化硅,Si原子成4个Si-O键、不含孤对电子,Si原子采取sp3杂化,该晶体中最小的环相当于金刚石六元环中C原子换成Si原子,Si-Si之间插入O原子,故最小的环中含有6个Si原子、6个O原子,共有12个原子,二氧化硅晶体属于原子晶体,微粒间的作用力为共价键,
故答案为:O=C=O;分子;sp3;12;共价键;
(3)若A元素的原子最外层电子排布为4s1,则A为K元素,处于第四周期ⅠA族.B元素的原子价电子排布为3s23p2,则B为Si元素,同周期自左而右第一电离能呈增大趋势,N元素2p能级为半满稳定状态,第一电离能高于同周期相邻元素,非金属性越强第一电离能越大,故第一电离能O>P>Si>Li,
故答案为:第四周期ⅠA族;O>P>Si>Li.
点评:本题考查结构性质位置关系、核外电子排布规律、常用化学用语、元素周期律等,难度中等,注意基础知识的理解掌握.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
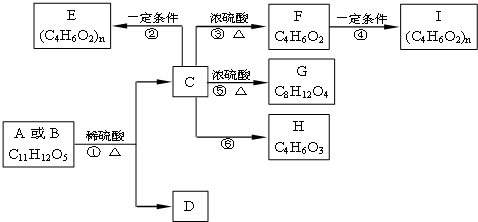
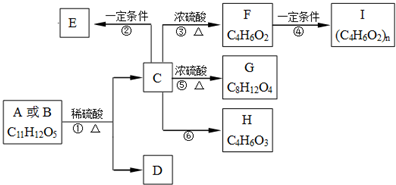
 ,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:
,现有A、B、C、D、E、F、G、H八种有机物,存在如下图所示的转化关系:


 (其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.
(其中R为饱和烃基),A在一定条件下有如图所示的转化关系.已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2.