题目内容
在一定温度下,在定压容器a与定容容器b中,分别通入等量且体积比为1:3的N2和H2,开始时体积相同,达到平衡时,N2的转化率是( )
| A、a大 | B、b大 |
| C、a、b一样大 | D、不一定 |
考点:化学平衡的计算
专题:化学平衡专题
分析:氮气和氢气的反应为N2(g)+3H2(g)?2NH3(g),该反应是一个反应前后气体体积减小的反应,增大压强平衡向正反应方向移动,则氮气的转化率增大,a容器内气体是恒压状态反应,b容器内气体是恒容状态反应,根据反应过程中两容器内气体的压强大小判断转化率的相对大小.
解答:
解:氮气和氢气的反应是一个反应前后气体体积减小的反应,气体的压强越大,氮气的转化率越大,随着反应的进行,a容器内气体的压强不变,b容器内气体的压强减小,a容器中气体的压强大于b容器中气体的压强,所以a容器中氮气的转化率大,
故选A.
故选A.
点评:本题考查了压强对化学平衡的影响,明确压强对化学平衡的影响结合该反应的特点来分析解答是解本题的关键,难度不大.

练习册系列答案
相关题目
 标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mL H2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A、亚硫酸的酸性比氢硫酸的酸性弱 |
| B、ab段反应是:SO2+2H2S═3S↓+2H2O |
| C、原H2S溶液的物质的量浓度为0.05mol/L |
| D、b点对应的溶液导电性最强 |
(双选)下列变化中属于原电池反应的是( )
| A、白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
| B、在空气中金属铝表面迅速被氧化形成保护膜 |
| C、红热的铁丝与水接触表面形成蓝色保护层 |
| D、在铁与稀H2SO4反应时,加几滴CuSO4溶液,可加快H2的产生 |
在pH相同的氢氧化钾和氨水两种溶液中( )
| A、H+的物质的量浓度相同 |
| B、溶质的物质的量浓度相同 |
| C、OH-的物质的量相同 |
| D、最多可中和硫酸的物质的量相同 |
根据下列物质的化学性质,判断其应用错误的是( )
| A、酒精能使蛋白质变性,可用于杀菌消毒 |
| B、CaO能用于燃煤的脱硫 |
| C、明矾水解时产生具有吸附性的胶体粒子,可以除去水中的杂质离子 |
| D、氯气泄露时,人群应向高处疏散 |
下列实验操作中一定会造成误差的是( )
| A、将pH试纸用蒸馏水湿润后测某溶液的pH |
| B、在中和热的测定实验中用Ba(OH)2代替NaOH;H2SO4代替HCl |
| C、用碱石灰来干燥氨气 |
| D、使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘 |
已知:2NO2(g) N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
 N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )| A、减小NO2的浓度 |
| B、降低温度 |
| C、增加压强 |
| D、升高温度 |
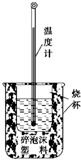 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: