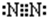题目内容
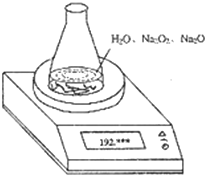 (2004?上海)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
(2004?上海)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560g、锥形瓶和水的质量为190.720g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
(2)计算过氧化钠质量分数时,必需的数据是
试样质量,锥形瓶加水的质量
试样质量,锥形瓶加水的质量
不必作第6次读数的原因是第4、5次读数相等,锥形瓶内质量已达到恒重
第4、5次读数相等,锥形瓶内质量已达到恒重
(3)测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
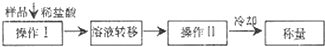
①操作Ⅱ的名称是
蒸发
蒸发
②需直接测定的物理量是
NaCl的质量
NaCl的质量
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要
烧杯
烧杯
、玻璃棒
玻璃棒
(固定、夹持仪器除外)④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果
偏大
偏大
(填偏大、偏小或不变).分析:(1)过氧化钠与水反应生成氢氧化钠与氧气;
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重;
(3)①由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶;
②最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量;
③在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量;
④转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,故Na2O2质量分数偏大.
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重;
(3)①由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶;
②最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量;
③在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量;
④转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,故Na2O2质量分数偏大.
解答:解:(1)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量,故需要知道试样质量、锥形瓶加水的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重,不需要作第6次读数,
故答案为:试样质量、锥形瓶加水的质量;第4、5次读数相等,锥形瓶内质量已达到恒重;
(3)①由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶,
故答案为:蒸发;
②最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量,
故答案为:NaCl的质量;
③在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量,
故答案为:烧杯、玻璃棒;
④转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,由于过氧化钠中钠元素的质量分数小于氧化钠中钠元素质量分数,故Na2O2质量分数偏大,
故答案为:偏大.
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)计算过氧化钠质量分数时,应用过氧化钠完全反应的数据,根据称量的锥形瓶+水+试样总质量变化计算生成氧气的质量,根据氧气的质量计算过氧化钠的质量,故需要知道试样质量、锥形瓶加水的质量;
由表中数据可知,第4、5次读数相等,锥形瓶内质量已达到恒重,不需要作第6次读数,
故答案为:试样质量、锥形瓶加水的质量;第4、5次读数相等,锥形瓶内质量已达到恒重;
(3)①由流程图可知,操作Ⅱ是从溶液中获得氯化钠晶体,应采取蒸发结晶,
故答案为:蒸发;
②最终蒸发冷却结晶得到晶体为氯化钠,故应测定NaCl的质量,
故答案为:NaCl的质量;
③在烧杯内用盐酸溶解样品,并用玻璃棒搅拌,在蒸发皿中加热蒸发结晶,并用玻璃棒搅拌,用天平称量氯化钠的质量,
故答案为:烧杯、玻璃棒;
④转移溶液时,如溶液转移不完全,烧杯内壁放出少量氯化钠,测定氯化钠的质量偏小,样品中钠元素的质量分数偏低,由于过氧化钠中钠元素的质量分数小于氧化钠中钠元素质量分数,故Na2O2质量分数偏大,
故答案为:偏大.
点评:本题考查物质含量测定、对实验方案的理解、物质分离提纯、误差分析等,主要考查实验基本技能与操作与测定原理,难度中等,是对学生综合能力的考查,难度中等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目