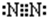题目内容
(2004?上海)某化学反应的反应物和产物如下:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(1)该反应的氧化剂是
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→

(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是
(1)该反应的氧化剂是
KMnO4
KMnO4
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是
8
8
②在下面的化学式上标出电子转移的方向和数目KMnO4+KI+H2SO4→


(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组.原因是
该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.
该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.
.分析:(1)根据元素的化合价的变化判断,反应物中元素的化合价降低的物质为氧化剂;
(2)①根据氧化剂得到的电子总数等于还原剂失去的电子总数进行解答;
②根据电子转移的表示方法,还原剂失去的电子总数指向氧化剂进行解答;
(3)该氧化还原反应的特点是两种氧化产物可能的配平系数有许多组,据此解答.
(2)①根据氧化剂得到的电子总数等于还原剂失去的电子总数进行解答;
②根据电子转移的表示方法,还原剂失去的电子总数指向氧化剂进行解答;
(3)该氧化还原反应的特点是两种氧化产物可能的配平系数有许多组,据此解答.
解答:解:(1)在氧化还原反应中,元素化合价的变化与发生反应的关系是:“升失氧,降得还,若说剂,正相反”.在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,锰元素化合价由+7价降低为+2价,锰元素被还原,还原产物是MnSO4,KMnO4是氧化剂,I元素的化合价由-1价升高为I2中的0价和KIO3中的+5价,KI作还原剂,发生氧化反应,
故答案为:KMnO4;
(2)①在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KMnO4是氧化剂,KI作还原剂,I元素的化合价由-1价升高为I2中的0价和KIO3中的+5价,如果该反应方程式中I2和KIO3的系数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为【0-(-1)】×10+【+5-(-1)】×5=40,反应中,锰元素化合价由+7价降低为+2价,每一锰原子参加反应得5个电子,根据氧化剂得到的电子总数等于还原剂失去的电子总数,所以8KMnO4~8MnSO4,
故答案为:8;
②该反应方程式中I2和KIO3的系数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为【0-(-1)】×10+【+5-(-1)】×5=40,在氧化还原反应中,用单线桥表示电子转移的方法是,从还原剂中变化的元素出发指向氧化剂中变化的元素,因此该反应中电子转移的方向和数目可表示为 ,故答案为:
,故答案为: ;
;
(3)在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KI作还原剂,I元素的化合价由-1价升高为I2中的0价和KIO3中的+5价,该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化,如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组,
故答案为:该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.
故答案为:KMnO4;
(2)①在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KMnO4是氧化剂,KI作还原剂,I元素的化合价由-1价升高为I2中的0价和KIO3中的+5价,如果该反应方程式中I2和KIO3的系数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为【0-(-1)】×10+【+5-(-1)】×5=40,反应中,锰元素化合价由+7价降低为+2价,每一锰原子参加反应得5个电子,根据氧化剂得到的电子总数等于还原剂失去的电子总数,所以8KMnO4~8MnSO4,
故答案为:8;
②该反应方程式中I2和KIO3的系数都是5,则10KI~5I2,5KI~5KIO3,反应中碘元素失去的电子总数为【0-(-1)】×10+【+5-(-1)】×5=40,在氧化还原反应中,用单线桥表示电子转移的方法是,从还原剂中变化的元素出发指向氧化剂中变化的元素,因此该反应中电子转移的方向和数目可表示为
 ,故答案为:
,故答案为: ;
;(3)在KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O反应中,KI作还原剂,I元素的化合价由-1价升高为I2中的0价和KIO3中的+5价,该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化,如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组,
故答案为:该反应式含两种氧化产物,两者的比例和氧化剂的用量都可发生变化.
点评:本题考查氧化还原反应基本概念与计算,正确进行氧化还原反应中的氧化剂、还原剂判断,明确元素的化合价及化合价在反应中的变化是解答本题的关键,题目难度中等.

练习册系列答案
相关题目