题目内容
【题目】氮、磷化合物用途非常广泛,如:磷化硼(BP)、磷青铜(Cu3SnP)等。回答问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_____。
(2)PH3分子的空间构型为______。PH3的键角小于NH3的原因是_____。
(3)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为_____,该化合物所含元素中电负性最大的是_______。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为______,其为_____元酸,原因是_____。
(5)磷化硼(BP)是倍受关注的耐磨材料,可用作金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。
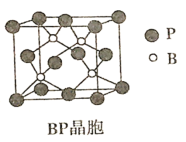
①磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______。
②已知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为_____g/cm3。
【答案】5s25p2 三角锥形 元素的电负性N>P,成键电子对离中心原子越近,成键电子对之间的排斥力越大,键角越大 sp3杂化 O 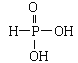 二 酸的元数与其形成的盐种类数目相同 正方形
二 酸的元数与其形成的盐种类数目相同 正方形 
【解析】
(1)Sn是50号元素,位于元素周期表第五周期第IVA族,根据构造原理书写基态锡原子的价电子排布式;
(2)PH3与NH3空间构型相同,结合P、N元素的电负性及电子对之间的排斥力大小比较;
(3)根据价层电子对数判断O原子杂化轨道类型;根据元素的非金属性越强,其电负性越大分析判断;
(4)只有羟基(-OH)氢能够与NaOH发生中和反应,酸是几元酸,就可形成几种盐据此分析判断;
(5)①该BP晶体在Z轴上投影,构成的是平面正方形结构;
②根据晶体密度ρ=![]() 计算;
计算;
(1)Sn是50号元素,位于元素周期表第五周期第IVA族,价层电子排布式是5s25p2;
(2) P原子价层电子对数为3+![]() =4,VSEPR构型为正四面体形,由于P原子上有1对孤对电子占据四面体的一个顶点,所以PH3呈三角锥形;由于元素的电负性:N>P,键合电子对偏向N,成键电子对之间的斥力大增大,电子对离中心原子更近,成键电子对之间的排斥力越大,键角越大,所以键角NH3比PH3的大;
=4,VSEPR构型为正四面体形,由于P原子上有1对孤对电子占据四面体的一个顶点,所以PH3呈三角锥形;由于元素的电负性:N>P,键合电子对偏向N,成键电子对之间的斥力大增大,电子对离中心原子更近,成键电子对之间的排斥力越大,键角越大,所以键角NH3比PH3的大;
(3)在-OH中O原子价层电子对数为4,因此杂化轨道类型为sp3杂化;在羟基磷灰石[Ca5(PO4)3OH]中含有的元素有Ca、P、O、H四种,由于元素的非金属性最强的元素是O元素,元素的非金属性越强,其电负性越大,因此物质所含元素电负性最大的是O元素;
(4)由于酸的元数与其和碱反应产生的盐种类数目相同,亚磷酸与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐,说明H3PO3是二元酸,分子中含有2个与P原子连接的-OH,其结构式为 ;
;
(5)①根据磷化硼(BP)晶胞结构可知B原子在Z轴上投影,形成的是平面正方形结构;
②在1个晶胞中,含有P原子数目为8×![]() +6×
+6×![]() =4,4个B原子在晶胞内,所以含有B原子数目为4个,则该晶胞的密度ρ=
=4,4个B原子在晶胞内,所以含有B原子数目为4个,则该晶胞的密度ρ=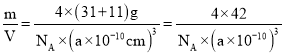 g/cm3。
g/cm3。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向盛有稀 | 试管口出现红棕色气体 | 溶液中的 |
B | 向某钠盐X溶液中加入盐酸,将产生的气体通入 | 有白色沉淀产生 | 反应生成的气体可能为 |
C | 向滴加酚酞的氨水中加蒸馏水稀释 | 溶液红色变浅 | 溶液中所有离子的浓度均减小 |
D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧 | 直接观察,火焰呈黄色 | 溶液中的金属阳离子只有 |
A.AB.BC.CD.D