题目内容
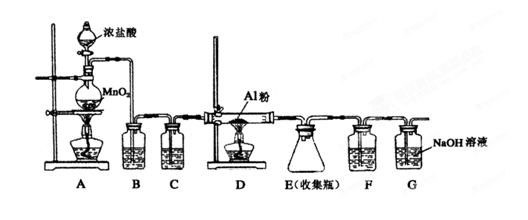
实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: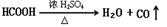 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
(1)若所制气体流向从左向右时,上述仪器连接为: A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
① 。② 。
(3)证明HCOOH受热产物中有CO的现象为: 。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO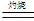 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式: 。
(6)请你评价方案②的合理性,并简述理由:方案②: ,理由: 。
(1)、A→(F ) →(C )→( E )→( B ) →( D )
(2)、①液封,防止气体从长颈漏斗中溢出 ②节约试剂 ③便于控制反应
(3)、B中黑色固体变为红色,D中溶液变浑浊。
(4)、g(或D) (5)、3Cu2O +14HNO3=6Cu(NO3)2+2NO↑ + 7H2O
(6)、合理 因为Cu2O可与稀硫酸溶液反应生成Cu2+ ,会使溶液变蓝。
解析试题分析:(1)用仪器组装设备的顺序是制取气体的装置、然后除杂、干燥装置、检验装置、反应装置、检验装置、尾气处理装置。有时为了安全起见,要加一个安全瓶,来防止倒吸现象的发生。因此若所制气体流向从左向右时。装置的连接顺序是A→F→C→E→B→D;(2)A装置中小试管的作用①液封,防止气体从长颈漏斗中溢出;②节约试剂;③便于控制反应;(3)若有CO气体产生,则在B中会发生反应:CuO+CO CO2+Cu,Cu是红色固体,CO2能使澄清的石灰水变浑浊。因此要证明HCOOH受热产物中有CO的现象为B中黑色固体变为红色,D中溶液变浑浊。(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气。(5)Cu2O与稀硝酸发生氧化还原反应的化学方程式是3Cu2O +14HNO3=6Cu(NO3)2+2NO↑ + 7H2O;(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O +2H+ = Cu+Cu2+ + H2O,会产生Cu2+ ,使溶液变蓝。因此方案②合理。
CO2+Cu,Cu是红色固体,CO2能使澄清的石灰水变浑浊。因此要证明HCOOH受热产物中有CO的现象为B中黑色固体变为红色,D中溶液变浑浊。(4)本实验有3处用到酒精灯,在A用于制取CO气体,在B处用于使CO与CuO发生氧化还原反应,在D处用于除去过量的CO,防止污染大气。(5)Cu2O与稀硝酸发生氧化还原反应的化学方程式是3Cu2O +14HNO3=6Cu(NO3)2+2NO↑ + 7H2O;(6)若固体是Cu单质,与稀硫酸不反应,若固体含有Cu2O,加入稀硫酸会发生反应:Cu2O +2H+ = Cu+Cu2+ + H2O,会产生Cu2+ ,使溶液变蓝。因此方案②合理。
考点:考查仪器的连接、物质的作用、检验、方程式的书写、方案的设计与评价的知识。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
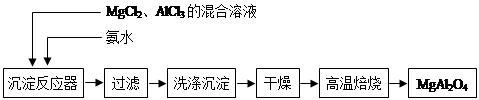
小学教材完全解读系列答案用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
| A.①⑥⑤③ | B.②③④③ | C.②③⑤③ | D.①③⑤③ |
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
_______________________________________________________________________________________。
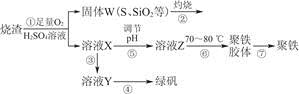
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下: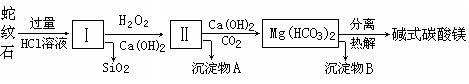
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 溶液,然后过滤、洗涤、 _________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:
(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将 ;
假设三:氯水有极强的氧化性,将 ;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
| 实验操作 | 预期现象 | 结论 |
| 取少量褪色后的溶液, | | 说明假设一是合理的 |
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为 。
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。
乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:___________________________
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则 (填“甲”或“乙”)判断正确。
(3)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH—浓度分别为amol /L和bmol /L,则a与b的比值= 。