题目内容
(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: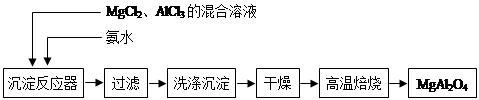
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。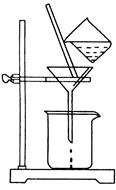
(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
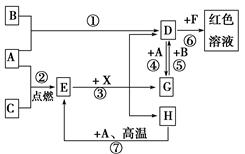
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。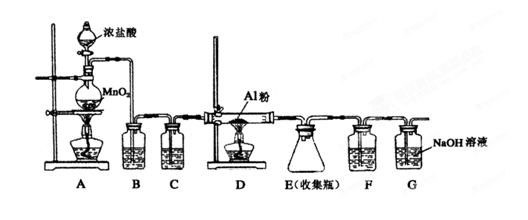
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(14分)(1)2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O(2分)
MgAl2O4 + 4H2O(2分)
(2)漏斗下端尖嘴未紧贴烧杯内壁(1分)AgNO3溶液(1分)坩埚(1分)
(3)Al(OH)3(1分) Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(4)除去HCl(1分);吸收水蒸气(1分) 碱石灰(2分)
(5)4.00(2分)
解析试题分析:(1)MgCl2、AlCl3的混合溶液与氨水反应生成氢氧化镁和氢氧化铝沉淀,经过滤、洗涤、干燥后高温焙烧生成MgAl2O4,所以该反应的反应物是氢氧化镁和氢氧化铝,产物是MgAl2O4和水,化学方程式为2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O;
MgAl2O4 + 4H2O;
(2)过滤存在中符合“一贴二低三靠”过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁;氯化镁与氯化铝在与氨水反应生成沉淀时,沉淀上易附着有氯离子,检验氯离子所用的试剂是硝酸银溶液;高温焙烧时,用于盛放固体的仪器是坩埚;
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11>Ksp[Al(OH)3]=3×10-34。所以先生成溶解度小的沉淀Al(OH)3;生成Al(OH)3沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)因为无水AlCl3遇潮湿空气即产生大量白雾,所以制备氯化铝时要求氯气是干燥的,而且浓盐酸易挥发,挥发的HCl也与Al反应,所以需除去HCl,装置B中盛放饱和NaCl溶液,目的就是除去氯气中的HCl;装置C中盛放浓硫酸,目的是干燥氯气;F中也盛放浓硫酸,目的是吸收G中的水蒸气,防止水蒸气进入D中;可用一件仪器装填适当试剂后也可起到F和G的作用,该试剂既能吸收水,还能吸收多余的氯气,所以应该是碱石灰;
(5)Mg、Cu都是2价金属,沉淀的质量也即Mg、Cu的质量加上OH-的质量。该过程中生成NO气体0.896L(标准状况)物质的量是0.04mol,则Mg、Cu失去电子的物质的量等于NO3-得电子的物质的量也等于OH-的物质的量,即n(OH-)=0.04mol×3=0.12mol,所以沉淀的质量是1.96g+0.12mol×17g/mol=4g。
考点:考查镁、铝化合物的性质,化学方程式的判断与书写,装置的作用判断,氧化还原反应的计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: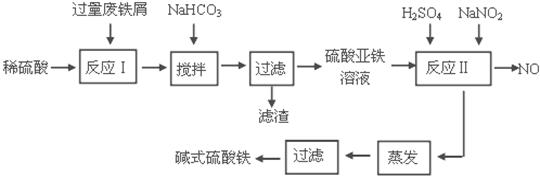
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:

则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。
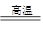 2Cu + SO2
2Cu + SO2 FeSO4 + Cu
FeSO4 + Cu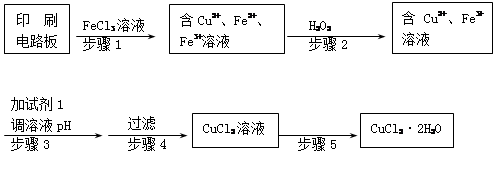
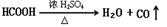 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
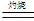 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+