题目内容
15.下列说法正确的是( )| A. | CH3COOH与NaOH在相同条件下电离程度相等 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 检验CO32-和HCO3-离子的方法是取少量样品加入盐酸,将产生的气体通入石灰水 |
分析 A.醋酸为弱电解质,氢氧化钠为强电解质,醋酸的电离程度一定小于氢氧化钠;
B.氯化钠在溶液中电离出钠离子和氯离子,所以能够导电;
C.电解质的电离不需要电流;
D.检验碳酸根离子可用氯化钡或氯化钙.
解答 解:A.醋酸为弱酸,在溶液中部分电离,氢氧化钠为强电解质,在溶液中完全电离,则醋酸的电离程度一定小于氢氧化钠,故A错误;
B.NaCl溶液中电离出带电荷、自由移动的Na+和Cl-,所以氯化钠溶液能够导电,故B正确;
C.H2SO4在水的作用下电离出H+和SO42-,不需要电流,故C错误;
D.检验CO32-可用氯化钡溶液,检验HCO3-离子是取少量样品加入盐酸,将产生的气体通入石灰水,故D错误;
故选B.
点评 本题考查了电解质的电离及其影响、常见离子的检验方法等知识,题目难度中等,注意掌握强弱电解质的区别,明确溶液导电性原因,熟练掌握常见离子的性质及检验方法,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列有关物质的表达式不正确的是( )
| A. | 乙烯的结构简式:CH2 CH2 | B. | CS2分子的结构式:S═C═S | ||
| C. | 醛基的结构简式:-CHO | D. | 羟基的电子式:${\;}_{\;}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H |
6.下列实验操作都能够达到预期目的是( )
①用精密pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
①用精密pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
| A. | ②④⑥ | B. | ②⑥ | C. | ①⑤ | D. | ④⑤⑥ |
3.在无色透明的酸性溶液中,能大量共存的离子是( )
| A. | K+、Cu2+、NO3-、SO42- | B. | Na+、S2-、Cl-、CH3COO- | ||
| C. | Na+、Ba2+、Cl-、SO42- | D. | Mg2+、Cl-、Ca2+、NO3- |
10.下列说法错误的是( )
| A. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| B. | 在一定条件下可实现下列转化MgCl2(溶液)→Mg(OH)2→MgO | |
| C. | 通过置换反应可实现由Mg到MgO的转化 | |
| D. | 镁与稀硝酸反应的离子方程式为:Mg+2H+═Mg+H2↑ |
20.在碱性溶液中能大量共存而且为无色透明的溶液是( )
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、SiO32-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Na+、SO42-、S2-、Cu2+ |
19.下列说法中正确的是( )
| A. | 在水电离出的c(H+)=1×10-13mol/L的溶液中下列离子一定能大量共存:Na+、CO32-、Cl-、K+ | |
| B. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 | |
| C. | K2SO3溶液中c(K+)与c(SO32-)之比为2:1 | |
| D. | 硫酸是强电解质,故纯硫酸能导电 |
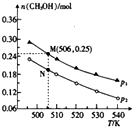 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.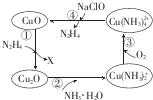 肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.
肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.