题目内容
(2013?泰安一模)物质的结构是决定物质性质的重要因素.请回答下列问题:
(1)基态Ni原子核外电子排布式为
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4═3N2+4H2O,若该反应中有4mol-H键断裂,形成的π键有
mol.
(1)基态Ni原子核外电子排布式为
1S22S22P63S23P63d84s2
1S22S22P63S23P63d84s2
;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C
C
.(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO
>
>
FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为6
6
.(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4═3N2+4H2O,若该反应中有4mol-H键断裂,形成的π键有
3
3
mol.
分析:(1)Ni是28号元素,其原子核外有28个电子,根据构造原理写出基态Ni原子核外电子排布式;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(2)影响离子晶体的因素有电荷因素和半径因素,NaCl中钠离子的配位数为6;
(3)根据-H键与π键的关系式计算.
(2)影响离子晶体的因素有电荷因素和半径因素,NaCl中钠离子的配位数为6;
(3)根据-H键与π键的关系式计算.
解答:解:(1)Ni的原子序数为28,根据能量最低原理可写出电子排布式为1S22S22P63S23P63d84s2,第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,
故答案为:1S22S22P63S23P63d84s2;C;
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO,NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6,
故答案为:>;6;
(3)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×3=3mol,故答案为:3.
故答案为:1S22S22P63S23P63d84s2;C;
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO,NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6,
故答案为:>;6;
(3)1mol氮气分子中含有2molπ键,若该反应中有4mol-H键断裂,即有1mol肼参加反应,生成1.5mol氮气,所以形成的π键有1.5mol×3=3mol,故答案为:3.
点评:本题考查电子排布式的书写、晶胞结构等知识点,难度不大,明确氮气分子中π键的个数.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )
(2013?泰安一模)用选项中的电极、溶液和如图所示装置可组成原电池.下列现象或结论叙述正确的是( )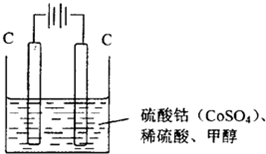 (2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.