题目内容
1.已知某KNO3溶液A中,混有少量的Ca2+和SO42-等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体.
根据上述回答:
(1)沉淀D中所含有的物质是CaCO3、BaCO3.
(2)写出除去Ca2+和SO42-的离子方程式:Ca2++CO32-═CaCO3↓、Ba2++SO42-═BaSO4↓.
(3)按上述实验方案值得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第③步有误,请加以改正:加足量硝酸.
分析 溶液A中,混有少量的Ca2+和SO42-等杂质,由分离流程可知,加硝酸钡,与硫酸根离子反应,则沉淀B为BaSO4,溶液C中含KNO3及Ca2+、Ba2+,再加碳酸钾,反应生成的沉淀D为CaCO3、BaCO3,则溶液E中含KNO3及碳酸钾,应加硝酸后蒸发结晶得到硝酸钾晶体,以此来解答.
解答 解:溶液A中,混有少量的Ca2+和SO42-等杂质,由分离流程可知,加硝酸钡,与硫酸根离子反应,则沉淀B为BaSO4,溶液C中含KNO3及Ca2+、Ba2+,再加碳酸钾,反应生成的沉淀D为CaCO3、BaCO3,则溶液E中含KNO3及碳酸钾,应加硝酸后蒸发结晶得到硝酸钾晶体,
(1)由上述分析可知,沉淀D为CaCO3、BaCO3,故答案为:CaCO3、BaCO3;
(2)除去Ca2+和SO42-的离子方程式为Ca2++CO32-═CaCO3↓、Ba2++SO42-═BaSO4↓,故答案为:Ca2++CO32-═CaCO3↓、Ba2++SO42-═BaSO4↓;
(3)由上述分析可知,E中含碳酸钾,则应加足量硝酸,故答案为:加足量硝酸.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 特氟隆(聚四氟乙烯)的单体是氟利昂 | |
| B. | 蛋白质是由氨基酸形成的可水解的高分子化合物,其水溶液有丁达尔现象 | |
| C. | 聚丙烯的结构简式为: | |
| D. | 石英的化学式为CaSiO3 |
9.对于溶液中某些离子的检验及结论正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有碳酸根离子 | |
| B. | 加入氯化钡溶液有白色沉淀生成,再加盐酸,沉淀不消失,一定有硫酸根离子 | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有氨根离子 | |
| D. | 为检验酸性溶液中的氯离子和硫酸根离子,应先加硝酸银溶液,滤去沉淀后加硝酸钡溶液 |
16.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2LNH3所含的原子数为2NA | |
| B. | 常温常压下,80gSO3含有的氧原子数为3NA | |
| C. | 标准状况下,22.4LH2中所含原子数为NA | |
| D. | 2 L0.3 mol•L-1 Na2SO4溶液中含0.6NA个Na+ |
10.下列说法正确的是( )
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{18}$O为不同的核素,有不同的化学性质 | |
| B. | H2、SO2、NH3三种气体都可用浓硫酸干燥 | |
| C. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 | |
| D. | 陶瓷、玻璃、水泥、大理石的主要成分都是硅酸盐 |
11.有Al、CuO、Fe2O3组成的混合物共10.0g,放入250mL某浓度的硫酸溶液中,混合物完全溶解,当再加入125mL 2.00mol/L的NaOH溶液时,得到沉淀物质的量最多.上述硫酸溶液的浓度为( )
| A. | 0.500 mol/L | B. | 1.00 mol/L | C. | 2.00 mol/L | D. | 3.00 mol/L |
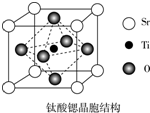 氢能被视作连接化石能源和可再生能源的重要桥梁.
氢能被视作连接化石能源和可再生能源的重要桥梁.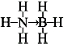 ;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机化合物是CH3CH3(写结构简式).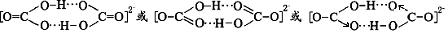 .
.