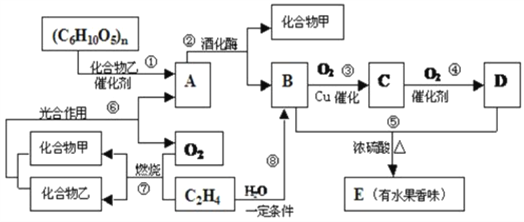
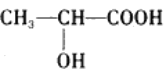
题目内容
【题目】氰化氢是剧毒物质,含有氰的废水对环境的污染和人体的危害非常严重。
(1)氢氰酸(HCN)的电子式为______。
(2)用电解的方法可以除去含有CN-、Cl-废水中的CN-,其原理是控制溶液pH为9-10,利用阳极产生的ClO-将CN-氧化为两种无污染的气体。
①阳极的电极反应式:_________。
②除去CN-的离子方程式为:_________。
(3)已知25℃时,HCN的电离常数Ka=4.9×10-10,则25℃时0.1mol/L 的HCN溶液中c(H+)=_____mol/L。NaCN溶液中加入盐酸至恰好完全反应,溶液中所有离子浓度的关系为___________。
【答案】 ![]() Cl--2e-+2OH-=C1O-+H2O H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH- 7×10-6 c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)
Cl--2e-+2OH-=C1O-+H2O H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH- 7×10-6 c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)
【解析】 (1)氢氰酸(HCN)的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)用电解的方法可以除去含有CN-、C1-废水中的CN-,其原理是控制溶液PH为9~10,利用阳极产生的C1O-将CN-氧化为两种无污染的气体。
①该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作负极,可以用较不活泼金属作正极,石墨做阳极,阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故答案为:Cl--2e-+2OH-=C1O-+H2O;
②阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故答案为:H2O+5C1O-+2CN-=2CO2+N2+5Cl-+2OH-;
(3) 根据HCN![]() H++CN-可知,Ka=
H++CN-可知,Ka=![]() =
=![]() =
=![]() =4.9×10-10,c(H+)= 7×10-6;NaCN溶液中加入盐酸至怡好完全反应生成等物质的量的氯化钠和HCN,溶液显酸性,溶液中所有离子浓度的关系为c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-),故答案为:7×10-6;c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)。
=4.9×10-10,c(H+)= 7×10-6;NaCN溶液中加入盐酸至怡好完全反应生成等物质的量的氯化钠和HCN,溶液显酸性,溶液中所有离子浓度的关系为c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-),故答案为:7×10-6;c(Na+)= c(Cl-)>c(H+)>c(CN-)>c(OH-)。

【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4·7H2O的过程如图所示:

硼镁泥的主要成分如下表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是________、_______。
(3)判断“除杂”基本完成的检验方法是____________。
(4)分离滤渣3应趁热过滤的原因是___________。