题目内容
由地壳中含量第一、第二的两种元素形成的化合物,不具有的性质是
- A.高温下可与生石灰发生化合反应
- B.熔点高
- C.与水作用生成相应的酸
- D.与碳共热可发生置换反应
由题目条件可推该化合物是二氧化硅。
A正确,SiO2+CaO=CaSiO3
B正确,二氧化硅是原子晶体,具有熔点高,硬度大等特点。
C错误,二氧化硅不溶于水。
D正确,二氧化硅在高温下与碳反应可以生成硅单质。

 阅读快车系列答案
阅读快车系列答案(13分)
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
(1)写出元素E基态原子的电子排布式: 。
(2)C2单质分子中,含有 个![]() 键和 个
键和 个![]() 键,元素B的气态氢化的空间构型为 。
键,元素B的气态氢化的空间构型为 。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)D单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
(13分)
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
(2)C2单质分子中,含有 个
 键和 个
键和 个 键,元素B的气态氢化的空间构型为 。
键,元素B的气态氢化的空间构型为 。(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)D单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
(13分)
现有部分前四周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
A |
第三周期中的半导体材科 |
|
B |
L层s电子数比p电子数少l |
|
C |
地壳中含量最高的元素 |
|
D |
第三周期主族元素中其第一电离能最大 |
|
E |
第四周期中未成对电子数最多 |
(1)写出元素E基态原子的电子排布式: 。
(2)C2单质分子中,含有 个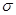 键和
个
键和
个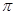 键,元素B的气态氢化的空间构型为
。
键,元素B的气态氢化的空间构型为
。
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)D单质的熔点 A单质的熔点(填“高于”或“低于”),其原因是:
。
