题目内容
运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na++H++SO42-.
(1)在NaHSO4溶液中c(H+)
(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol?L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:
Ⅱ.(1)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出相关的电解化学方程式:
(2)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的
Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na++H++SO42-.
(1)在NaHSO4溶液中c(H+)
=
=
c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH>
>
7.(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol?L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:
CO32-+H+═HCO3-
CO32-+H+═HCO3-
;向此反应后的溶液中滴加0.001mol?L-1BaCl2溶液,首先析出的沉淀是BaSO4
BaSO4
.[KSP(BaSO4)=1.1×10-10mol2?L-2;KSP(BaCO3)=5.1×10-9mol2?L-2]Ⅱ.(1)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出相关的电解化学方程式:
2ZnSO4+2H2O
2Zn+O2↑+2H2SO4
| ||
2ZnSO4+2H2O
2Zn+O2↑+2H2SO4
.
| ||
(2)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的
负
负
极发生氧化
氧化
反应而损耗,铁受到保护.分析:Ⅰ、(1)根据溶液中的电荷守恒以及硫酸氢钠与氢氧化钡溶液之间的反应来分析;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,根据Ksp的含义进行计算;
Ⅱ、(1)根据电解池的工作原理来书写电解方程式;
(2)在原电池中,活泼金属做负极,发生失电子的氧化反应.
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,根据Ksp的含义进行计算;
Ⅱ、(1)根据电解池的工作原理来书写电解方程式;
(2)在原电池中,活泼金属做负极,发生失电子的氧化反应.
解答:解:Ⅰ.(1)根据NaHSO4=Na++H++SO42-,在硫酸氢钠中存在电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(OH-)+c(SO42-),用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则氢氧化钡中的氢氧根过量,溶液显碱性,pH>7,故答案为:=;>;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,即CO32-+H+═HCO3-,向此反应后的溶液中滴加
0.001mol?L-1BaCl2溶液,根据Ksp的含义:越小,越易生成沉淀,所以首先析出的沉淀BaSO4,
故答案为:CO32-+H+═HCO3-;BaSO4;
Ⅱ.(1)电解硫酸锌的原理方程式为:2ZnSO4+2H2O
2Zn+O2↑+2H2SO4,
故答案为:2ZnSO4+2H2O
2Zn+O2↑+2H2SO4;
(2)镀锌铁板的镀锌层一旦被破坏后,较活泼金属锌将作为原电池的负即,发生失电子的氧化反应,
故答案为:负;氧化.
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,即CO32-+H+═HCO3-,向此反应后的溶液中滴加
0.001mol?L-1BaCl2溶液,根据Ksp的含义:越小,越易生成沉淀,所以首先析出的沉淀BaSO4,
故答案为:CO32-+H+═HCO3-;BaSO4;
Ⅱ.(1)电解硫酸锌的原理方程式为:2ZnSO4+2H2O
| ||
故答案为:2ZnSO4+2H2O
| ||
(2)镀锌铁板的镀锌层一旦被破坏后,较活泼金属锌将作为原电池的负即,发生失电子的氧化反应,
故答案为:负;氧化.
点评:本题考查了学生:电解质的电离、沉淀溶解平衡常数以及原电池的电解池的电极方程式的书写,属于综合知识的考查,难度较大.

练习册系列答案
相关题目
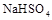 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则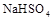 在水中的电离方程式为
在水中的电离方程式为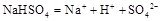
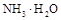 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)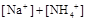
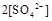 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钠溶液制取硫酸钡,若溶液中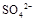 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)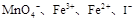 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后: 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是