题目内容
7.某温度下22%的硝酸钠溶液150毫升,加100克水稀释后浓度变为14%,则原溶液的物质的量浓度约为3mol/L(结果取整数).分析 可假设原溶液的质量为mg,根据溶液稀释前后溶质的质量不变计算m,根据质量分数计算NaNO3的质量,根据n=$\frac{m}{M}$计算NaNO3的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:设原溶液的质量为mg,
则根据溶液稀释前后溶质的质量不变,则m×22%=(m+100)×14%,解之得m=175,
则在150mL溶质的质量分数为22%的NaNO3溶液中,含NaNO3的质量为175×22%=38.5g,
NaNO3的物质的量为$\frac{38.5g}{85g/mol}$=0.45mol,
原溶液的物质的量浓度是$\frac{0.45mol}{0.15L}$=3mol/L,
故答案为:3mol/L.
点评 本题考查物质的量浓度计算,侧重考查分析计算能力,明确稀释前后溶质不变是解本题关键,熟练掌握物质的量有关公式,题目难度不大.

练习册系列答案
相关题目
17.在医院中,为酸中毒病人输液不应采用( )
| A. | 0.9%氯化钠溶液 | B. | 1.25%碳酸氢钠溶液 | ||
| C. | 0.9%氯化铵溶液 | D. | 5%葡萄糖溶液 |
18.制造焊锡时,把铅加入锡的主要原因是( )
| A. | 增加强度 | B. | 增加抗腐蚀能力 | C. | 增加延展性 | D. | 降低熔点 |
15.下列物质属于非电解质的是( )
| A. | NaCl | B. | Cu | C. | NaOH | D. | CH3CH2OH |
2.阿司匹林是一种常用的退热、镇痛药物,其结构简式如图:下列有关阿司匹林的叙述正确的是( )
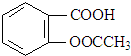

| A. | 阿司匹林的分子式为C9H8O4 | |
| B. | 阿司匹林苯环上的一氯取代物有2种 | |
| C. | 阿司匹林能与NaHCO3溶液反应,最多能与5 mol H2发生加成反应 | |
| D. | 1 mol 阿司匹林与足量NaOH溶液反应,最多消耗NaOH的量为2 mol |
12.香烟燃烧产生的烟气中含有尼古丁(化学式C10H14N2)、焦油、一氧化碳等,下列说法中错误的是( )
| A. | 吸烟有害健康 | |
| B. | 尼古丁中C、H、N三种元素的质量比为5:7:1 | |
| C. | CO比O2更易同血红蛋白结合,会导致人体缺氧 | |
| D. | 尼古丁中氮元素的质量分数约为17.3% |
19.下列气体中,有颜色的是( )
| A. | O2 | B. | Cl2 | C. | SO2 | D. | NH3 |
16.常温下,物质的量浓度相同的三种盐NaX、NaY和NaZ溶液的pH值依次为8、9、10,则下列表达式错误的是( )
| A. | Z-+H2O═HZ+OH- | B. | HY+H2O═H3O++Y- | ||
| C. | 常温下,电离度:HX>HY>HZ | D. | HX+Z-→X-+HZ |
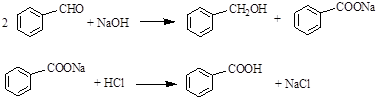
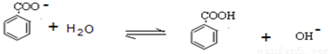 .
.