题目内容
用双线桥法标明下列化学方程式中电子转移的方向和数目并分析下列氧化还原反应,完成下列填空.
(1)2Al+Fe2O3
Al2O3+2Fe
氧化剂为______,氧化产物为______,0.4molAl参加反应时,转移的电子数目是______NA.
(2)2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O
被氧化的元素的原子结构示意图为______,氧化性:KMnO4______Cl2(填“<”、“>”或“=”).
(1)2Al+Fe2O3
| ||
氧化剂为______,氧化产物为______,0.4molAl参加反应时,转移的电子数目是______NA.
(2)2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O
被氧化的元素的原子结构示意图为______,氧化性:KMnO4______Cl2(填“<”、“>”或“=”).
(1)Fe2O3+3Al
Al2O3+3Fe中Fe元素化合价降低,被还原,Fe2O3为氧化剂,Al元素化合价升高,被氧化,为还原剂,则Fe得到2×3e-,Al失去2×3e-,氧化产物为Al2O3,电子转移数目和方向可表示为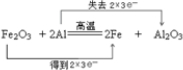 ,0.4mol Al参加反应时,转移的电子数目是1.2NA.
,0.4mol Al参加反应时,转移的电子数目是1.2NA.
故答案为:Fe2O3;Al2O3;1.2; ;
;
(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,Cl元素被氧化,失去的电子为5×2×(1-0)e-=10e-,双线桥标出反应中电子的转移方向和数目为 ,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为
,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为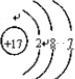 ,
,
故答案为: ;>;
;>; .
.
| ||
 ,0.4mol Al参加反应时,转移的电子数目是1.2NA.
,0.4mol Al参加反应时,转移的电子数目是1.2NA.故答案为:Fe2O3;Al2O3;1.2;
 ;
;(2)反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7降低为+2,KMnO4为氧化剂,得到的电子为2×(7-2)e-=10e-,Cl元素的化合价由-1升高为0,HCl为还原剂,Cl元素被氧化,失去的电子为5×2×(1-0)e-=10e-,双线桥标出反应中电子的转移方向和数目为
 ,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为
,反应中,氧化性KMnO4>Cl2,Cl元素原子结构示意图为 ,
,故答案为:
 ;>;
;>; .
.
练习册系列答案
相关题目