题目内容
某小组对Cu与浓HNO3的反应进行研究。记录如下:
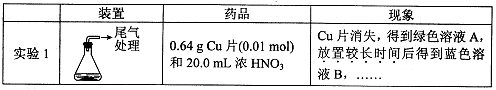
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2- Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:

①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。

I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2-
 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:

①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。
Ⅰ、Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O (2分)
Ⅱ、(1)溶液A和溶液B中,c(Cu2+)基本相同; (2分)
(2)溶液由蓝变绿,(1分) 溶液由绿变蓝, (1分) 有红棕色气体逸出 (1分)
(3)①3 HNO2= HNO3+2NO↑+H2O (2分)
②加入稀硫酸 ,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成Cu2++4 NO2- Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)
Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)
(4)A中剩余浓硝酸溶解了NO2得到黄色溶液与Cu(NO3)2蓝色溶液混合而形成的绿色;(2分)
实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中NO2-不能大量存在,因此,A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+和NO2-反应生成Cu(NO2)42-不是使溶液呈绿色的主要原因。(2分)
Ⅱ、(1)溶液A和溶液B中,c(Cu2+)基本相同; (2分)
(2)溶液由蓝变绿,(1分) 溶液由绿变蓝, (1分) 有红棕色气体逸出 (1分)
(3)①3 HNO2= HNO3+2NO↑+H2O (2分)
②加入稀硫酸 ,抑制HNO2的电离,并使HNO2分解,降低c(NO2-),造成Cu2++4 NO2-
 Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)
Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色; (2分)(4)A中剩余浓硝酸溶解了NO2得到黄色溶液与Cu(NO3)2蓝色溶液混合而形成的绿色;(2分)
实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中NO2-不能大量存在,因此,A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+和NO2-反应生成Cu(NO2)42-不是使溶液呈绿色的主要原因。(2分)
试题分析:Ⅰ、Cu与浓HN03反应的化学方程式是Cu+4HNO3(浓)= Cu(NO3)2+2NO2↑+2H2O;
Ⅱ、(1)铜片完全溶解后,溶液A和溶液B中,c(Cu2+)基本相同;
(2)乙认为溶液呈绿色是由溶解的NO2引起的,当将NO2通入B中时溶液应由蓝变绿,再通入氮气,红棕色二氧化氮气体逸出,溶液又由绿变回蓝色;
(3)①HNO2中氮元素为+3价,分解时应发生歧化反应,化学方程式为3HNO2=HNO3+2NO↑+H2O
②从化学平衡移动角度分析。HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。加入稀硫酸 ,抑制HNO2的电离,并促使HNO2分解,降低c(NO2-),造成Cu2++4 NO2-
 Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;
Cu(NO2)42-平衡向逆反应方向移动,绿色变蓝色;(4)由实验3得溶液呈绿色的主要原因是A中剩余浓硝酸溶解了NO2得到黄色溶液与Cu(NO3)2蓝色溶液混合而形成的绿色;实验4中加稀硫酸,溶液变为蓝色,说明酸性较强的A溶液中NO2-不能大量存在,因此,A溶液中绿色的Cu(NO2)42-不能大量存在,Cu2+和NO2-反应生成Cu(NO2)42-不是使溶液呈绿色的主要原因。

练习册系列答案
相关题目
 KCl+2NH3↑
KCl+2NH3↑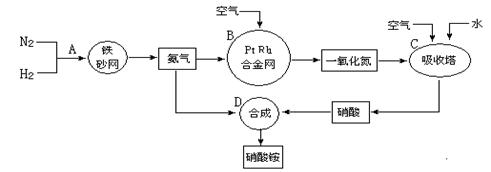

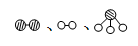 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)