题目内容
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
A | |||||||||||||
B | C | D | |||||||||||
E | F | G |
(1)画出C的原子结构示意图:_________________。
(2)E在元素周期表中的位置是_________________。
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是_____________(填化学式)。
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是_____________(填化学式)。
(5)A、B、G三元素形成的化合物的电子式是________________,其中所含的化学键有哪些类型________________。
(6)B的最高价氧化物的水化物的稀溶液与金属铜反应的离子方程式为___________________。
【答案】  第三周期第VA族 HF HClO4
第三周期第VA族 HF HClO4 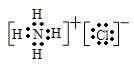 离子键和共价键 3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
离子键和共价键 3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
【解析】(1)C为O元素,原子序数为8,原子核外有两个电子层,最外层电子数为6,则原子结构示意图为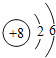 ;
;
(2)E为P元素,原子序数为15,核外有3个电子层,最外层电子数为5,则位于周期表第三周期ⅤA族;
(3)B、C、D、F四种元素中非金属性最强的是F元素,对应的氢化物的稳定性最强,故HF最稳定;
(4)同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强;
(5)A、B、G三元素形成的化合物为NH4Cl,为离子化合物,含有离子键和共价键,电子式为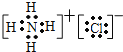 ;
;
(6)稀硝酸溶解Cu生成硝酸铜和NO,发生反应的离子方程式为3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O。

练习册系列答案
相关题目
