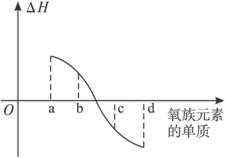
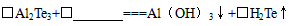题目内容
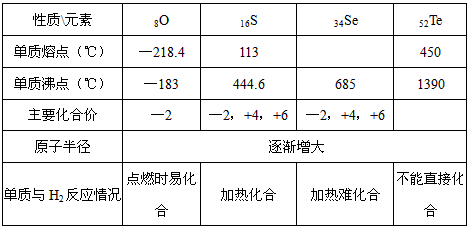
氧族元素单质与H2反应情况为:
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
⑴氧族元素形成的氢化物的稳定性由强到弱的顺序是: 。
⑵工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
( )A12Te3+( ) =( )Al(OH)3↓+( )H2Te↑
⑶在101kPa时,4.0g硫粉在氧气中完全燃烧生成SO2,放出37kJ的热量,则硫燃烧的
热化学方程式为 。
![]()
![]()
![]()
解析:
此题考查了元素周期律的知识和化学方程式热化学方程式的书写,问题⑴考查了氧族元素氢化物的稳定性,非金属元素单质与氢气化合时越容易,生成的氢化物的稳定性越强,反之,稳定性越弱,结合题给信息可得出稳定性强弱:H2O ﹥H2S ﹥H2Se﹥H2Te。问题⑵考查了化学方程式的书写,根据反应前后元素守恒可以确定未知反应物的化学式和各物质的计量数,化学方程式为:Al2Te3 + 6H2O ===== Al(OH)3 ↓ + 3H2Te↑。问题⑶考查了热化学方程式的书写,书写热化学方程式时要注明各物质的状态,放热反应的△H﹤0,根据题给信息可以计算出1mol硫粉完全燃烧生成SO2 放出的热量为296KJ,硫燃烧的化学方程式为:
S(s) + O2(g)==== SO2 (g);△H =-296KJ/mol。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案元素 | O | S | Se | Te |
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)氧族元素形成的氢化物的稳定性由强到弱的顺序是___________________________。
(2)工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
( )Al2Te3+( )____________====( )Al(OH)3↓+( )H2Te↑
(3)在101 kPa时,
 归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).
归纳整理是科学学习的重要方法之一.在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分).