��Ŀ����
ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʡ�ˮ������ֱ��Ӱ�����彡��
��1�����н϶�______________��ˮ��ΪӲˮ��Ӳˮ���Ⱥ�������������ӷ���ʽΪ__________________________( д������һ�ֳ�����ļ���) ��
��2����ͼΪij����ˮ������Ȼˮ�Ʊ�����ˮ(ȥ����ˮ)�Ĺ�������ʾ��ͼ��
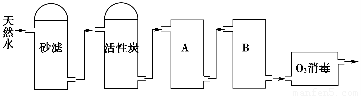
������̿��������__________________��O3�������ŵ���________________��
��A��B�з��õ��������Ʒֱ��ǣ�A__________________��B_______________��A��B�з��õ������Ƿ���Ի���?��˵��ԭ��________________________________________��
��3��ͨ��ʩ��һ��ѹ��ʹˮ����ͨ����Ĥ��������ӻ����ӽ���, �Ӷ���ô���ˮ�ķ�����Ϊ?????????????????? ��������������ˮʱ, ʹ����ͨ����Ĥ���ƶ�����??????????????????? ? ��
��4����������ˮ�Ĵ���ʱ, ������еķ����Dzⶨˮ�� ?????????????? ��
��5��ij �� �� �� ˮ ��c(Ca2+)Ϊ1.0��10-3mol/L, c(Mg2+)Ϊ5.0��10-4mol/L,c(HCO3_)Ϊ8.0��10-4mol/L������ҩ��������1000L ,Ӧ����Ca(OH) 2???????????? g , Na2CO 3 __________ g ��
��1��C a2+ �� M g2+ (2����C a2++ 2 H C O3��  CaC O 3��+C O 2��+
CaC O 3��+C O 2��+
H 2O( �� ? Mg2++ 2HCO3��  MgCO3��+CO2��+H2O??? MgCO3+2H2O=Mg(OH)2+CO2��+H2O )(2����
MgCO3��+CO2��+H2O??? MgCO3+2H2O=Mg(OH)2+CO2��+H2O )(2����
��2��������ˮ�е��л���(��ȥ��ˮ�е���ζ)��1�֣�����Ӧ�������������ӽ�����֬�������ӽ�����֬��2�֣�ˮ�е�Ca2+ ��Mg2+������������֬�е�OH- ����Mg(OH)2��Ca(OH)2������ɶ����������ӽ�����֬��1�֣�
��3�������� ��1�֣����Ʋ��糡����1�֣�
��4���絼�ʻ�����ʣ�1�֣���5)66.6 ��2�֣�?? 116.6��2�֣�
��������
�����������1������Ӳˮ�ĸ�����н϶�Ca2����Mg2����ˮ��Ӳˮ���ڼ��ȵ������£�̼�����ο��Էֽ�����̼���Σ�C a2++ 2 HCO3��  CaCO 3��+CO 2��+H 2O( �� Mg2++2HCO3��
CaCO 3��+CO 2��+H 2O( �� Mg2++2HCO3��  MgCO3��+CO2��+H2O ��MgCO3+2H2O=Mg(OH)2+CO2��+H2O )��
MgCO3��+CO2��+H2O ��MgCO3+2H2O=Mg(OH)2+CO2��+H2O )��
��2���ٻ���̿������Ϊ����ˮ�е��л����ȥ��ˮ�е���ζ����O3�������ŵ��Ƿ�Ӧ����������AΪ�����ӽ�����֬��BΪ�����ӽ�����֬��ˮ�е�Ca2+ ��Mg2+������������֬�е�OH- ����Mg(OH)2��Ca(OH)2������ɶ����������ӽ�����֬��
��3������������һ���������ӽ���Ĥ���к�ˮ�����ķ���������ӵ糡�������£�ˮ��Һ�����������ӻ�ֱ��������ƶ���������м����һ�ֽ���Ĥ���Ϳ��ܴﵽ����Ũ����Ŀ�ģ����Ե�����������ˮʱ��ʹ����ͨ����Ĥ���ƶ����ǵ��Ʋ��糡�����ʴ�Ϊ�������������Ʋ��糡������
��4����Ϊˮ�ĵ���̶ȼ�С�����Դ�ˮ�Ǽ���������ģ����Ҫ��������ˮ�Ĵ���ʱ��������еķ����Dzⶨˮ�ĵ絼�ʻ�����ʣ�
��5)c��Ca2����Ϊ1.0��10-3mol��L��1��c��Mg2����Ϊ5.0��10-4mol��L��1��c��HCO3����Ϊ8.0��10-4mol��L��1������ҩ��������1000L��
n��Ca2����=1000L��1.0��10-3mol��L��1=1mol��n��Mg2����=1000L��5.0��10-4mol��L��1=0.5mol��n��HCO3����=1000L��8.0��10-4mol��L��1=0.8mol��
�����������Ʒ����ķ�ӦΪ��
Mg2��+2OH��=Mg(OH)2��?
0.5mol 1mol?
HCO3��+OH��=CO32��+H2O
0.8mol 0.8mol
����Ҫn��OH����=1.8mol��
����ҪCa(OH)2������Ϊ1.8mol�� ��74g��mol��1=66.6g��
��74g��mol��1=66.6g��
ˮ��Һ��Ca2�����ʵ���Ϊ1mol+0.9mol=1.9mol��
������Ҫ�����̼�������Ϊ1.9mol-0.8mol=1.1mol��������Ϊ1.1mol��106g��mol��1=116.6g��
�ʴ�Ϊ��66.6��116.6��
���㣺����������롢�ᴿ������ԭ�����ۺ��Խ�ǿ�����ط������������������Ŀ��飬ע�⻯ѧ�뼼������ѧ���������ϵ��
