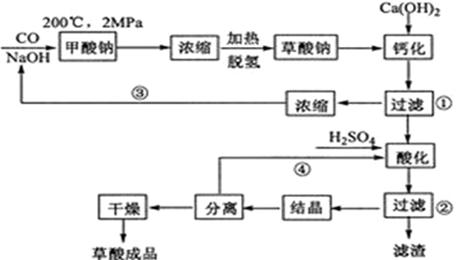
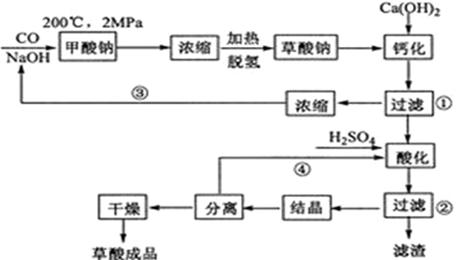
题目内容
[化学--选修2:化学与技术]
水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康.请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl-和SO
.则该硬水的硬度属于 (填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加 后加 .
(2)我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1L水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测.
═实验中涉及的部分反应:
M2+(金属离子)+EBT(铬黑T)=MEBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA)=MY2-
MEBT+Y4-(EDTA)=MY2-+EBT(铬黑T)
实验过程:
①取地下水样品25.00mL进行预处理.写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式: ;
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是 ;
③将处理后的水样转移到250mL的锥形瓶中,加入氨水--氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.01000mol?L-1的EDTA标准溶液进行滴定.滴定终点的颜色变化为 ,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为 .
水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康.请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl-和SO
2- 4 |
(2)我国规定饮用水的硬度不能超过25度.硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1L水中含有10mg CaO称为1度.某化学实验小组对本地区地下水的硬度进行检测.
═实验中涉及的部分反应:
M2+(金属离子)+EBT(铬黑T)=MEBT
蓝色 酒红色
M2+(金属离子)+Y4-(EDTA)=MY2-
MEBT+Y4-(EDTA)=MY2-+EBT(铬黑T)
实验过程:
①取地下水样品25.00mL进行预处理.写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是
③将处理后的水样转移到250mL的锥形瓶中,加入氨水--氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.01000mol?L-1的EDTA标准溶液进行滴定.滴定终点的颜色变化为
分析:(1)根据水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度;根据除杂时不能引入新的杂质;
(2)①根据Ca(HCO3)2和Mg(HCO3)2的性质分析水垢形成的过程、写出水垢形成的过程的化学方程式;
②反应生成的二氧化碳能溶于水,要加热除去;
③EDTA标准溶液的浓度和消耗的体积,求出金属离子的物质的量,再求出氧化钙的质量和水的硬度.
(2)①根据Ca(HCO3)2和Mg(HCO3)2的性质分析水垢形成的过程、写出水垢形成的过程的化学方程式;
②反应生成的二氧化碳能溶于水,要加热除去;
③EDTA标准溶液的浓度和消耗的体积,求出金属离子的物质的量,再求出氧化钙的质量和水的硬度.
解答:解:(1)因水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度;已知水中主要含Ca2+、Mg2+、Cl-和SO42-,则该硬水的硬度属于永久硬度;因除杂时不能引入新的杂质,过量的钙离子通过纯碱来除去,故先加石灰,后加纯碱,
故答案为:永久; 石灰;纯碱;
(2)①由于自然界的水中大都溶有一定量的Mg(HCO3)2,在受热时生成Mg(OH)2,这种白色固体在容器内壁上积淀,即形成水垢,所以水垢形成的过程的方程式为:Mg(HCO3)2
Mg(OH)2↓+2CO2↑,
故答案为:Mg(HCO3)2
Mg(OH)2↓+2CO2↑;
②预处理的方法是向水样中加入浓盐酸,盐酸与Mg(HCO3)2反应生成二氧化碳,CO2能溶于水,所以要加热煮沸除去,
故答案为:除去溶解的CO2;
③根据已知反应可知滴定前溶液为酒红色,滴定结束后为蓝色,所以溶液颜色变化为酒红色变为蓝色;
用0.01000mol?L-1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则n(M2+)=n(EDTA)=0.01000mol?L-1×15.00×10-3=1.5×10-4mol,
则25ml水中m(CaO)=nM=56g/mol×1.5×10-4mol=8.2mg,所以1L水中m(CaO)=8.2mg×
=336mg,通常把1L水中含有10mg CaO称为1度,所以该地下水的硬度为
=33.6度,
故答案为:酒红色变为蓝色;33.6度.
故答案为:永久; 石灰;纯碱;
(2)①由于自然界的水中大都溶有一定量的Mg(HCO3)2,在受热时生成Mg(OH)2,这种白色固体在容器内壁上积淀,即形成水垢,所以水垢形成的过程的方程式为:Mg(HCO3)2
| ||
故答案为:Mg(HCO3)2
| ||
②预处理的方法是向水样中加入浓盐酸,盐酸与Mg(HCO3)2反应生成二氧化碳,CO2能溶于水,所以要加热煮沸除去,
故答案为:除去溶解的CO2;
③根据已知反应可知滴定前溶液为酒红色,滴定结束后为蓝色,所以溶液颜色变化为酒红色变为蓝色;
用0.01000mol?L-1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则n(M2+)=n(EDTA)=0.01000mol?L-1×15.00×10-3=1.5×10-4mol,
则25ml水中m(CaO)=nM=56g/mol×1.5×10-4mol=8.2mg,所以1L水中m(CaO)=8.2mg×
| 1000 |
| 25 |
| 336mg |
| 10mg |
故答案为:酒红色变为蓝色;33.6度.
点评:本题是一道化学和生活相结合的题目,注重知识的迁移应用,难度不大,能较好的考查学生分析和解决问题的能力.

练习册系列答案
相关题目

 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]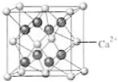 (4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是
(4)B与Ca形成的晶体的晶胞如右图所示,其中Ca2+的配位数是