题目内容
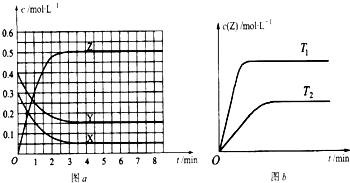
 已知反应X(g)+Y(g)?nZ(g)△H<0,将X和Y 以一定比例混合通入2L密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法正确的是( )
已知反应X(g)+Y(g)?nZ(g)△H<0,将X和Y 以一定比例混合通入2L密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法正确的是( )| A、反应方程式中n=2 | B、该反应的△S>0 | C、10min时,曲线发生变化的原因是增大压强 | D、0~5min内,平均反应速率v(X)=0.04mol?L-1?min-1 |
分析:A.10min时反应物和生成物浓度瞬间同时增大,说明是增大了压强,且平衡发生了移动,则反应前后气体的体积不相等;
B.达到平衡时,增大压强后反应物浓度逐渐减小,生成物浓度增加,说明该反应是体积缩小的反应,即n=1,该反应是熵变减小的反应;
C.10min时各组分浓度在瞬间都发生了变化,说明是增大了压强;
D.0~5min时,x的物质的量从2mol变为1.8mol,根据体积计算出浓度,再根据v=
计算出平均反应速率v(X).
B.达到平衡时,增大压强后反应物浓度逐渐减小,生成物浓度增加,说明该反应是体积缩小的反应,即n=1,该反应是熵变减小的反应;
C.10min时各组分浓度在瞬间都发生了变化,说明是增大了压强;
D.0~5min时,x的物质的量从2mol变为1.8mol,根据体积计算出浓度,再根据v=
| △c |
| △t |
解答:解:A.由于在10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,平衡发生了移动,即压强影响该可逆反应,该反应前后气体体积一定不相等,所以n一定≠2,故A错误;
B.由于10min时增大压强后,在重新达到平衡状态过程中,反应物浓度逐渐减小,生成物浓度逐渐增加,说明平衡向着正向移动,根据增大压强,平衡向着体积缩小的方向移动,所以该反应是体积缩小的反应,应该满足n<1+1,则n=1,该反应是混乱度减小的反应,即△S<0,故B错误;
C.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故C正确;
D.在5min时X的物质的量为1.8mol,0~5minx的物质的量变化为2mol-1.8mol=0.2mol,则该时间段X的平均反应速率为:v(X)=
=
=0.02mol?L-1?min-1,故D错误;
故选C.
B.由于10min时增大压强后,在重新达到平衡状态过程中,反应物浓度逐渐减小,生成物浓度逐渐增加,说明平衡向着正向移动,根据增大压强,平衡向着体积缩小的方向移动,所以该反应是体积缩小的反应,应该满足n<1+1,则n=1,该反应是混乱度减小的反应,即△S<0,故B错误;
C.根据图象数据可知,10min时反应物和生成物浓度瞬间同时增大,则说明10min时增大了压强,故C正确;
D.在5min时X的物质的量为1.8mol,0~5minx的物质的量变化为2mol-1.8mol=0.2mol,则该时间段X的平均反应速率为:v(X)=
| △c |
| △t |
| ||
| 5min |
故选C.
点评:本题考查了化学平衡的影响因素、物质的量随时间变化的曲线、化学反应速率的计算,题目难度中等,注意明确影响化学反应速率的因素,能够正确分析物质的量随时间变化的曲线是解题关键,还要明确化学反应速率的概念及计算方法.

练习册系列答案
相关题目
已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
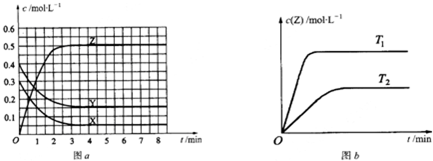

| A、发生反应时,各物质的反应速率大小关系为:v(X)=v(Y)=2v(Z) | B、图a中反应达到平衡时,Y的转化率为37.5% | C、增大压强,平衡向正反应方向移动 | D、该反应正反应的反应热△H>0 |
 (2009?广州二模)已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
(2009?广州二模)已知可逆反应X(g)+Y(g)?Z(g)(未配平).温度为T0时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( ) (1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:
(1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式: