题目内容
(2012?濮阳二模)已知反应X(g)+3Y(g)?2Z(g);△H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L.下列说法正确的是( )
分析:A、根据充入稀有气体后反应体系中各组分的浓度是否变化判断;
B、根据正逆反应速率相等及反应速率与计量数成正比分析;
C、根据增大容器容积,相当于减小了压强分析X的浓度变化;
D、根据恒温恒压条件下,若加入的初始物浓度满足化学计量数,达到平衡一定为等效平衡分析.
B、根据正逆反应速率相等及反应速率与计量数成正比分析;
C、根据增大容器容积,相当于减小了压强分析X的浓度变化;
D、根据恒温恒压条件下,若加入的初始物浓度满足化学计量数,达到平衡一定为等效平衡分析.
解答:解:A、恒温恒容条件下通入稀有气体,由于各组分的浓度不变,所以化学平衡不发生移动,故A错误;
B、达到平衡状态,正逆反应速率相等,由于X的计量数与Y的计量数之比为1:3,所以X的正反应速率是Y的逆反应速率的1/3,故B正确;
C、扩大容器体积至原来的两倍,假设平衡不变,X物质的量浓度等于0.2mol/L,实际由于压强减小平衡左移,浓度大于0.2mol/L,但是会小于0.4mol/L,故C错误;
D、恒温恒压下,如果加入各组分的物质的量满足各物质的化学计量数关系,再增加Z的物质的量,达到平衡时为等效平衡,各组分的浓度不变,X的浓度仍然为0.4mol/L,故D错误;
故选B.
B、达到平衡状态,正逆反应速率相等,由于X的计量数与Y的计量数之比为1:3,所以X的正反应速率是Y的逆反应速率的1/3,故B正确;
C、扩大容器体积至原来的两倍,假设平衡不变,X物质的量浓度等于0.2mol/L,实际由于压强减小平衡左移,浓度大于0.2mol/L,但是会小于0.4mol/L,故C错误;
D、恒温恒压下,如果加入各组分的物质的量满足各物质的化学计量数关系,再增加Z的物质的量,达到平衡时为等效平衡,各组分的浓度不变,X的浓度仍然为0.4mol/L,故D错误;
故选B.
点评:本题考查了化学平衡的建立过程,题目难度中等,注意反应条件是恒温恒压还是恒温恒容,该题是高考中的常见题型,对学生的思维能力提出了较高的要求,有利于培养学生的分析、理解能力及逻辑推理能力.

练习册系列答案
相关题目
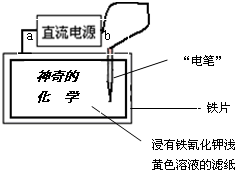 (2012?濮阳二模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出蓝色的字“神奇的化学”,据此判断下列说法正确的是( )
(2012?濮阳二模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出蓝色的字“神奇的化学”,据此判断下列说法正确的是( )