题目内容
已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。推断A—W物质各是什么,回答下列问题。
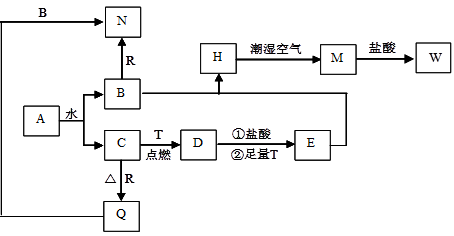
(1)写出下列物质的化学式:D: N: 。
(2)A和水的反应属于下列何种反应类型 (填序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(3)若要确定E溶液中是否含有W物质,所选试剂为 (填序号)。
A.氯水和KSCN溶液 B.KSCN溶液
C.浓氨水 D.酸性高锰酸钾溶液
(4)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(5)B和R反应生成N的离子方程式: ;
M→W的离子方程式: ;

(1)写出下列物质的化学式:D: N: 。
(2)A和水的反应属于下列何种反应类型 (填序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(3)若要确定E溶液中是否含有W物质,所选试剂为 (填序号)。
A.氯水和KSCN溶液 B.KSCN溶液
C.浓氨水 D.酸性高锰酸钾溶液
(4)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: ;
(5)B和R反应生成N的离子方程式: ;
M→W的离子方程式: ;
(1)D:Fe3O4 N:NaAlO2 (2)B C (3)B
(4)溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色
(5)2Al+2OH-+2H2O══ 2AlO2-+3H2↑ Fe(OH)3+3H+=Fe3++3H2O
(4)溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色
(5)2Al+2OH-+2H2O══ 2AlO2-+3H2↑ Fe(OH)3+3H+=Fe3++3H2O
试题分析:A为淡黄色固体Na2O2。它与水反应得到B为NaOH,C为O2。NaOH与Al发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑得到N:NaAlO2。O2与R:Al发生反应4Al+3O2
 2Al2O3得到Q Al2O3;Al2O3与NaOH溶液发生反应:Al2O3+2NaOH=2NaAlO2+2H2O.得到N:NaAlO2。O2与T:Fe在点燃时反应得到D:Fe3O4。Fe3O4与足量的HCl及Fe作用下得到E:FeCl2.FeCl2与NaOH发生反应得到H:Fe(OH)2.Fe(OH)2在潮湿的空气中发生反应4Fe(OH)2 + O2+2H2O == 4Fe(OH)3得到M:Fe(OH)3.Fe(OH)3与HCl发生酸碱中和反应Fe(OH)3+3HCl= FeCl3+3H2O.得到W:FeCl3和水。(1)D为Fe3O4。N为NaAlO2。(2)A和水的反应2Na2O2+2H2O="4NaOH+" O2↑由于在反应前后元素的化合价发生了变化,所以属于氧化还原反应。又由于有离子的参加,所以该反应还是离子反应。离子方程式为2Na2O2+2H2O =4Na++4OH-+ O2↑。因此选项为B、C。(3)若要确定E:FeCl2溶液中是否含有W FeCl3物质。只要确定含有Fe3+即可。所选试剂为KSCN溶液。若含有Fe3+,溶液会变为血红色,否则就不含有Fe3+。(4)B NaOH与E FeCl2混和得到H Fe(OH)2并在潮湿空气中变成M Fe(OH)3的过程中,观察到的现象是:溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色。(5)B NaOH和Ral反应生成N NaAlO2的离子方程式为2Al+2OH-+2H2O══ 2AlO2-+3H2↑ 。M Fe(OH)3→W FeCl3的离子方程式为:Fe(OH)3+3H+=Fe2++3H2O 。
2Al2O3得到Q Al2O3;Al2O3与NaOH溶液发生反应:Al2O3+2NaOH=2NaAlO2+2H2O.得到N:NaAlO2。O2与T:Fe在点燃时反应得到D:Fe3O4。Fe3O4与足量的HCl及Fe作用下得到E:FeCl2.FeCl2与NaOH发生反应得到H:Fe(OH)2.Fe(OH)2在潮湿的空气中发生反应4Fe(OH)2 + O2+2H2O == 4Fe(OH)3得到M:Fe(OH)3.Fe(OH)3与HCl发生酸碱中和反应Fe(OH)3+3HCl= FeCl3+3H2O.得到W:FeCl3和水。(1)D为Fe3O4。N为NaAlO2。(2)A和水的反应2Na2O2+2H2O="4NaOH+" O2↑由于在反应前后元素的化合价发生了变化,所以属于氧化还原反应。又由于有离子的参加,所以该反应还是离子反应。离子方程式为2Na2O2+2H2O =4Na++4OH-+ O2↑。因此选项为B、C。(3)若要确定E:FeCl2溶液中是否含有W FeCl3物质。只要确定含有Fe3+即可。所选试剂为KSCN溶液。若含有Fe3+,溶液会变为血红色,否则就不含有Fe3+。(4)B NaOH与E FeCl2混和得到H Fe(OH)2并在潮湿空气中变成M Fe(OH)3的过程中,观察到的现象是:溶液中出现白色沉淀,在空气中迅速变成灰绿色,最终变成红褐色。(5)B NaOH和Ral反应生成N NaAlO2的离子方程式为2Al+2OH-+2H2O══ 2AlO2-+3H2↑ 。M Fe(OH)3→W FeCl3的离子方程式为:Fe(OH)3+3H+=Fe2++3H2O 。
练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目

 )=1:1:14
)=1:1:14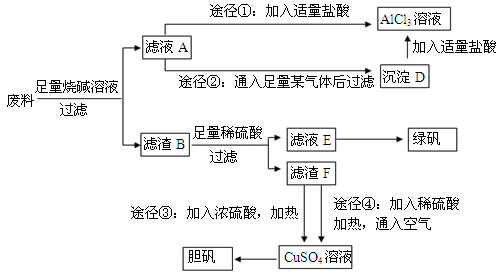
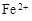 和
和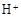 外,还可能存在 (用元素符号表示)。
外,还可能存在 (用元素符号表示)。