题目内容
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HclO |
分析 根据元素周期表中元素的第一电离能与化合价的变化规律及溶液的酸碱性与pH的关系、强酸制弱酸原理等知识来解本题,并注意规律中的特殊情况.
解答 解:A、同周期元素,第一电离能的变化趋势为:从左到右,逐渐增大,但镁和铝例外,理由是镁的价电子排布是3s2,3p轨道全空较稳定,而铝是3s23p1,不是全满,全空,半空中任意一种情况,不稳定,故铝的第一电离能比镁小,故A错误;
B、卤族元素中,氟元素没有正价,故B错误;
C、酸性是指c(H+)>c(OH-),而pH实际反映的是c(H+),水的离子积常数受温度影响,即pH=6.8 不能说明溶液一定显酸性,故C错误;
D、根据强酸制弱酸原理,强酸可以与弱酸的盐溶液反应制取弱酸,故D正确;
故选:D.
点评 本题考查了元素周期律、溶液酸碱性等知识,解题时要注意一般规律与特殊情况的关系,以及规律所适用的条件等.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
1.如图为电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )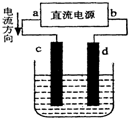

| A. | a为负极、b为正极 | B. | 电解过程中,化学能转化为电能 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,C电极发生还原反应 |
8.为检验某卤代烃(R-X)中的X元素,有下列实验操作,操作先后顺序正确的是( )
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃
④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却.
①加热煮沸 ②加入AgNO3溶液 ③取少量卤代烃
④加入稀硝酸酸化 ⑤加入NaOH溶液 ⑥冷却.
| A. | ③①⑤⑥②④ | B. | ③②①⑥④⑤ | C. | ③⑤①⑥④② | D. | ③⑤①⑥②④ |
18.化合物 是一种除草剂,它含有的官能团为( )
是一种除草剂,它含有的官能团为( )
 是一种除草剂,它含有的官能团为( )
是一种除草剂,它含有的官能团为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
5.将干燥的氯气分别通入盛有干花和鲜花的集气瓶后,干花不褪色而鲜花褪色表明( )
| A. | 氯气具有漂白作用 | B. | 鲜花比干花容易衰败 | ||
| C. | 次氯酸见光易分解 | D. | 次氯酸具有漂白作用 |
2.生活中碰到的某些问题常常涉及到化学知识,下列分析正确的是( )
| A. | 水在人体内没有调节体温的作用,但水是一种很好的溶剂 | |
| B. | 胃酸过多的人不宜吃海带、鸡肉、苹果等酸性食物 | |
| C. | 凡是有甜味的物质都是糖类,因此糖尿病人不能吃有甜味的食品 | |
| D. | 可用灼烧的方法来鉴别某白色纺织品的成分是真蚕丝还是“人造丝” |
15.下列物质能用化合反应直接制得的是( )
①FeCl2 ②Fe(OH)3 ③FeCl3 ④Fe(OH)2.
①FeCl2 ②Fe(OH)3 ③FeCl3 ④Fe(OH)2.
| A. | ①③ | B. | ①②③ | C. | ②③ | D. | ②④ |
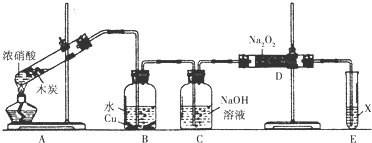
 ;
;