题目内容
【题目】镁铝合金用途很广泛,比如用作手机机身,我校课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数. I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金 ![]() 溶液
溶液 ![]() 称量灼烧产物的质量.
称量灼烧产物的质量.
(1)镁铝合金的硬度比金属铝的硬度(选填:大、小).
(2)若实验中需要240mL0.6mol/L盐酸,配制时需要量取密度为1.2g/mL 质量分数为36.5%浓盐酸的体积为mL,所需的玻璃仪器有:烧杯、玻璃棒、量筒、 .
(3)用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
(4)II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示: 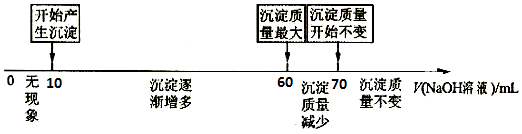
当加入60~70mL氢氧化钠溶液时,请写出发生的离子方程式 .
(5)请判断,根据上图数轴中的数据能否求出合金中铝的质量分数?(选填“能”或“不能”). 下列①②两题选一题作答.
①若不能求出合金中铝的质量分数,请说明理由 .
②若能求出合金中铝的质量分数,则铝的质量分数为 .
【答案】
(1)大
(2)12.5;250ml容量瓶 、 胶头滴管
(3)合金样品的质量
(4)Al(OH)3+2OH﹣=2 AlO2﹣+H2O
(5)能;空;52.94%
【解析】解:I.(1)镁铝合金的硬度比金属铝的硬度大,所以答案是:大;(2)物质的量浓度C= ![]() mol/L=
mol/L= ![]() =12mol/L,
=12mol/L,
稀释前后盐酸的物质的量不变,浓盐酸体积= ![]() =0.0125L=12.5ml;选取容量瓶规格应该等于或稍大于配制溶液体积,实验室没有240mL容量瓶,有250mL容量瓶,所以应该选取250mL容量瓶,所需的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,
=0.0125L=12.5ml;选取容量瓶规格应该等于或稍大于配制溶液体积,实验室没有240mL容量瓶,有250mL容量瓶,所以应该选取250mL容量瓶,所需的玻璃仪器有:烧杯、玻璃棒、量筒、250mL容量瓶、胶头滴管,
所以答案是:12.5;250mL容量瓶、胶头滴管;(3)灼烧得到的是氧化镁,所以要计算合金中镁的质量分数,还需要称量合金样品的质量,
所以答案是:合金样品的质量;
II.(4)当加入60~70ml氢氧化钠溶液时,沉淀的质量减小,是氢氧化铝与氢氧化钠发生反应生成了偏铝酸钠,反应的离子方程式为:Al(OH)3+2OH﹣=2 AlO2﹣+H2O,
所以答案是:Al(OH)3+2OH﹣=2 AlO2﹣+H2O;(5)①空;
②根据数轴可知,溶解氢氧化铝消耗的氢氧化钠溶液是70mL﹣60mL=10mL,则生成氢氧化铝消耗的氢氧化钠溶液体积应该是30mL,所以生成氢氧化镁消耗的氢氧化钠溶液体积是60mL﹣10mL﹣30mL=20mL,则根据方程式Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓可知Al和Mg的物质的量之比是1:1的,则铝的质量分数是 ![]() ×100%=52.94%,
×100%=52.94%,
所以答案是:能;52.94%.

 全能闯关100分系列答案
全能闯关100分系列答案