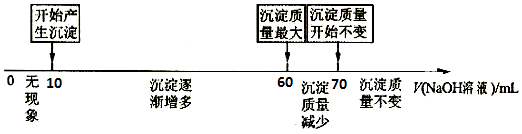
题目内容
【题目】实验法是化学重要的研究物质性质的基本方法.某化学研究小组进行了如下实验,请回答问题.
(1)用脱脂棉包住过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,看到脱脂棉剧烈燃烧起来. ①由上述实验现象所得到的有关过氧化钠跟水反应的结论是:
第一,有氧气生成,第二, . Na2O2跟水反应的化学方程式是 , 如果有1mol O2生成,则转移mol 电子.
②该研究小组拟用右图所示装置(气密性良好)证明上述结论.
用以验证第二条结论的实验操作及现象是: .
(2)①将光亮的无绣铁钉放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 . ②另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中有Fe2+ , 应选用的试剂编号为 .
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液乙同学把气体Y通入足量氯水中,写出发生反应的离子方程式为: . 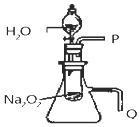
【答案】
(1)反应放出热量;2Na2O2+2H2O═4NaOH+O2↑;2; Q导管放入盛水的水槽中有气泡产生
(2)铁表面被钝化; d; SO2+Cl2+2H2O=4H++2Cl﹣+SO42﹣
【解析】解:(1)①往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,可知反应生成氧气,且反应放出热量,发生的反应为2Na2O2+2H2O═4NaOH+O2↑,因为氧气的氧由﹣1价升高到0价,所以如果有1mol O2生成,则转移2mol 电子;所以答案是:反应放出热量;2Na2O2+2H2O═4NaOH+O2↑;2;
②用右图所示装置进行实验,用以验证第二条结论的实验方法是Q导管放入盛水的水槽中有气泡产生,
所以答案是:Q导管放入盛水的水槽中有气泡产生;(2)①光亮的无绣铁钉放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行,所以答案是:铁表面被钝化;
②a.氯水能将亚铁离子氧化为铁离子,铁离子和KSCN溶液反应导致溶液呈血红色,但不能确定原来溶液中一定含有亚铁离子,故a错误;
b.铁粉和酸反应生成亚铁离子,不能确定原来溶液中是否含有亚铁离子,故b错误;
c.浓氨水和亚铁离子反应生成氢氧化亚铁沉淀,氢氧化亚铁能被氧化生成氢氧化铁红褐色沉淀,不能确定溶液中一定含有亚铁离子,故c错误;
d.亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,所以可以用酸性高锰酸钾溶液检验亚铁离子,故d正确;
乙把气体Y通入足量氯水中,生成的Y即SO2具有还原性,通入足量氯水中,发生反应为:SO2+Cl2+2H2O=2HCl+H2SO4,离子方程式为:SO2+Cl2+2H2O=4H++2Cl﹣+SO42﹣,所以答案是:d;SO2+Cl2+2H2O=4H++2Cl﹣+SO42﹣.

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案【题目】图是2008年北京奥运会的“祥云”火炬,与悉尼奥运火炬所用主要燃料(丁烷)不同,“祥云”火炬所用燃料为丙烷.丙烷和丁烷的沸点如下表:
丙烷 | 丁烷 | |
沸点/℃ | ﹣42.6 | ﹣0.5 |
下列有关说法中不正确的是( )
A.丙烷燃烧生成的产物无害,是环保型燃料
B.丙烷的沸点比丁烷低,是因为分子间作用力比丁烷弱
C.丙烷在低温时保持的压力比丁烷大
D.丙烷和丁烷都不存在同分异构体