题目内容
6.实验室用20g软锰矿(主要成分MnO2)与200mL 12mol/L的浓盐酸(足量)反应,制得标准状况下4.48L Cl2.(1)软锰矿中MnO2的质量分数是多少?
(2)反应中被氧化的HCl物质的量为多少?
分析 (1)盐酸足量,二氧化锰完全反应,根据n=$\frac{V}{Vm}$计算4.48L Cl2的物质的量,根据方程式计算参加反应的二氧化锰,根据m=nM计算二氧化锰的质量,再根据质量分数定义计算;
(2)反应中被氧化的HCl生成氯气,根据氯原子守恒可知,被氧化的HCl物质的量为氯气的2倍.
解答 解:(1)盐酸足量,二氧化锰完全反应,标准状况下生成4.48L Cl2,其物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,
则:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1 1
0.2mol 0.2mol
故二氧化锰的质量为0.2mol×87g/mol=17.4g,
故软锰矿中MnO2的质量分数=$\frac{17.4g}{20g}$×100%=87%,
答:软锰矿中MnO2的质量分数为87%;
(2)反应中被氧化的HCl生成氯气,根据氯原子守恒可知,被氧化的HCl物质的量为氯气的2倍,故被氧化的HCl的物质的量=0.2mol×2=0.4mol,
答:被氧化的HCl的物质的量为0.4mol.
点评 本题考查根据方程式进行的有关计算,难度不大,侧重对学生基础知识的考查.

练习册系列答案
相关题目
16.在体积恒定的密闭容器中,一定量的SO2与1.100mol O2在催化剂作用下加热到600℃发生反应:2SO2+O2$?_{加热}^{催化剂}$2SO3,该反应为放热反应.当气体的物质的量减少0.315mol时反应达到平衡,在相同的温度下测得气体压强为反应前的82.5%.下列有关叙述正确的是( )
| A. | 当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 | |
| B. | 降低温度,正反应速率减小,而逆反应速率增大 | |
| C. | 将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g | |
| D. | 达到平衡时,SO2的转化率是90% |
17.如表所示的四种元素中,W、X、Y、Z均为短周期元素,其中Y是地壳中含量最高的元素,且这四种元素的原子最外层电子数之和为22,下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Z和氢三种元素形成的化合物中只有共价键 | |
| C. | 原子半径的大小顺序:r(X)>r(Y)>r(W)>r(Z) | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
14.在新制饱和氯水中,若只改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 加入少量的碳酸钠粉末,pH增大,溶液漂白性增强 | |
| C. | 加入少量固体NaOH,一定有c(Na+)═c( Cl-)+c(ClO- ) | |
| D. | 加入少量水,水的电离平衡向逆反应方向移动 |
1.下列叙述正确的是( )
| A. | 容量瓶和量筒上均标有温度,且量筒和容量瓶均无“0”刻度 | |
| B. | 用丁达尔现象可鉴别蛋白质溶液、葡萄糖溶液和淀粉溶液 | |
| C. | 用洁净玻璃棒蘸取少量溶液,放在酒精灯上灼烧,透过蓝色钴玻璃观察K的焰色 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
11.下列说法中正确的是( )
①自然界中不存在游离态的硫
②将氯气通入石蕊试液先变红后褪色,将SO2通入石蕊试液也能褪色.
③二氧化硫的排放会导致光化学烟雾的产生
④二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
⑤向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
⑥浓硫酸可用来干燥SO2、CO、C12等气体
⑦将SO2通入硝酸钡溶液,生成白色沉淀BaSO3
⑧SiO2有导电性,所以可用于制光导纤维.
①自然界中不存在游离态的硫
②将氯气通入石蕊试液先变红后褪色,将SO2通入石蕊试液也能褪色.
③二氧化硫的排放会导致光化学烟雾的产生
④二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性
⑤向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
⑥浓硫酸可用来干燥SO2、CO、C12等气体
⑦将SO2通入硝酸钡溶液,生成白色沉淀BaSO3
⑧SiO2有导电性,所以可用于制光导纤维.
| A. | ①③⑤⑦ | B. | ⑥ | C. | ①②③④⑤⑦⑧ | D. | ②④⑥⑧ |
18.有关放热反应的说法中错误的是( )
| A. | 燃烧反应一定是放热反应 | |
| B. | 反应物总能量大于生成物总能量 | |
| C. | 反应物键能总和大于生成物键能总和 | |
| D. | 是体系将储存的能量释放出来的过程 |
15.有机物甲的结构简式如图,下列说法正确的是( )


| A. | 可用新制氢氧化铜悬溶液鉴别有机物甲、乙醇和甲酸乙酯 | |
| B. | 1mol该有机物可以消耗5molBr2 | |
| C. | 与稀H2SO4共热生成两种有机物 | |
| D. | 与NaOH溶液共热可消耗6molNaOH |
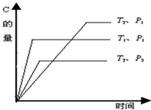 可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.
可逆反应2A(g)+nB(g)?mC(g)在温度分别为T1、T2,压强分别为P1、P2的条件下,测得C的量与时间的关系如图. 根据图分析,P1、P2的大小关系为P2>P1;反应式中系数m和n的关系是2+n<m;该反应的逆反应是放热反应.