题目内容
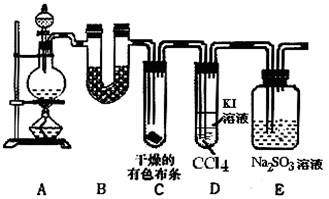
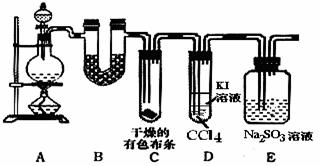
实验室制取氯气如下图,连接好实验装置。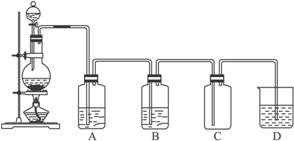
(1)连接好装置后,先___________。
(2)向烧瓶里加入少量___________粉末,分液漏斗中注入密度为1.19 g·cm-3的___________,慢慢地将分液漏斗中的液体注入烧瓶。
(3)___________加热,氯气便能放出。
(4)A中盛放的是___________,其作用为__________________________________。
(5)B中盛放的是___________,其作用为__________________________________。
(6)C的要求和作用是_______________________________________________。
(7)D中盛放的是___________,其作用为_________________________________。
(8)从中可以得出氯气的物理性质为__________________________________________。
解析:由制Cl2的反应特点确定气体发生装置,有杂质HCl、H2O的存在考虑A、B净化装置,Cl2能溶,比空气重,确定了用长进短出排气法收集,而Cl2有毒应进行尾气处理。
答案:(1)检查气密性 (2)MnO2 浓盐酸 (3)酒精灯 (4)饱和NaCl 吸收HCl (5)浓H2SO4 除H2O (6)长进短出,收集Cl2 (7)NaOH溶液 吸收多余Cl2 (8)黄绿色气体,不溶于饱和NaCl溶液

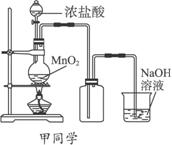
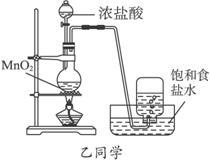
完成下列问题:
(1)写出实验中制备氯气的化学反应方程式:________________________________。
(2)对于乙同学的实验装置,要停止实验应怎样操作________________________。
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验。实验操作、现象、结论均相同。
记录如下:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
② | 加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物有较强的酸性 |
请你评价甲、乙两同学得出实验①②的结论是否合理?若不合理,请说明理由____________
_____________________________。
(4)丙同学查阅资料发现,HClO的氧化性大于MnO2,拟用下列四组试剂在实验室制取氯气:
A.CaCl2和次氯酸 B.浓盐酸和NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四组试剂中____________组试剂既符合实际,且Cl的利用率最高,写出这个反应的化学方程式:________________________________________________。