题目内容
【题目】下列说法正确的是
A.向盛有硫酸铜溶液的试管里加入过量氨水,将得到深蓝色的[Cu(NH3)4]SO4·H2O沉淀
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键,其立体构形都是正四面体
【答案】C
【解析】
A.向盛有硫酸铜溶液的试管里加入适量氨水,会生成蓝色的Cu(OH)2沉淀,再加入氨水,将得到深蓝色溶液。再向其中加入乙醇,可得到深蓝色的[Cu(NH3)4]SO4·H2O晶体:A项错误;
B.CH4分子中的碳原子上有两个2s电子和两个2p电子,在外界条件的影响下,一个2s电子发生跃迁,这样CH4分子中的碳原子就有一个2s轨道电子和三个2p轨道电子,一个2s轨道和三个2p轨道重新组合形成sp3杂化轨道,再与氢原子形成四个共价键,B项错误;
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子,未参与杂化的p轨道,可用于形成π键,C项正确;
D.AB3型的共价化合物,其中心原子A不一定采用sp3杂化轨道成键,如BF3中B原子的价层电子对数=![]() ,B原子采用sp2杂化,其立体构型为平面三角形,D项错误;
,B原子采用sp2杂化,其立体构型为平面三角形,D项错误;
答案选C。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
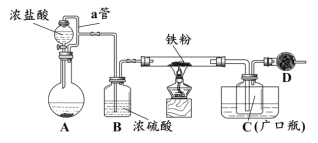
周周清检测系列答案【题目】以SO2、软锰矿(主要成分MnO2,少量Fe、Al、Ca及Pb的化合物等)、氨水及净化剂等为原料可制备MnSO4溶液和Mn3O4,主要实验步骤如下:

步骤Ⅰ:如图所示装置,将SO2通入B中的软锰矿浆液中(MnO2+SO2 = MnSO4)。
步骤Ⅱ:充分反应后,在不断搅拌下依次向三口烧瓶中加入适量纯净的MnO2、MnCO3,最后加入适量Na2S沉铅等重金属。
步骤Ⅲ:过滤得MnSO4溶液。
(1)装置A用于制取SO2,反应的化学方程式为_____。
(2)装置B中反应应控制在90~100℃,适宜的加热方式是_____。
(3)装置C的作用是_____。
(4)“步骤Ⅱ”中加入纯净MnO2的目的是_____,用MnCO3调节溶液pH时,需调节溶液pH范围为_____(该实验条件下,部分金属离子开始沉淀和沉淀完全的pH如下)。
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀pH | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全pH | 9.18 | 3.27 | 4.9 | 10.2 |
(5)已知:①用空气氧化Mn(OH)2浊液可制备Mn3O4[6Mn(OH)2+O2![]() 2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
2Mn3O4+6H2O],主要副产物为MnOOH;反应温度和溶液pH对产品中Mn的质量分数的影响如下图所示:
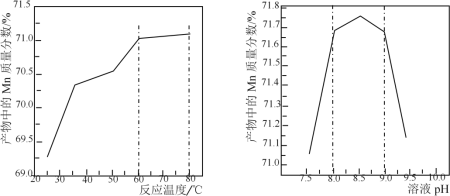
②反应温度超过80℃时,Mn3O4产率开始降低。
③Mn(OH)2是白色沉淀,Mn3O4呈黑色;Mn3O4、MnOOH中锰的质量分数理论值依次为72.03%、62.5%。
请补充完整由步骤Ⅲ得到的MnSO4溶液,并用氨水等制备较纯净的Mn3O4的实验方案:_____,真空干燥6小时得产品Mn3O4。
【题目】按要求填空:
(1)在第二周期中(稀有气体除外),第一电离能最大的元素的原子结构示意图是___,第一电离能最小的元素的电子排布图为___。
(2)以下是一些原子的2p能级和3d能级中电子排布的情况.试判断,哪些违反了泡利不相容原理,哪些违反了洪特规则。
①![]() ②
②![]() ③
③ ![]() ④
④![]() ⑤
⑤ ![]() ⑥
⑥ ![]()
违反泡利不相容原理的有__,违反洪特规则的有___。
(3)用VSEPR模型和杂化轨道理论相关知识填表:
分子或离子 | 中心原子轨道杂化形式 | 分子或离子的立体结构 | 分子有无极性 |
CH2O | ________ | _______ | _____ |
NH4+ | ________ | _______ | _____ |
CS2 | ________ | _______ | _____ |