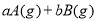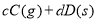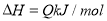题目内容
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
(1)④>②>①>③(2)④>②>③>①(3)11
【解析】
试题分析:(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH3?H2O为弱电解质,电离是微弱的,而CH3COONH4 、NH4HSO4 、(NH4)2SO4为强电解质,全部电离,所以NH3.H2O中NH4+浓度最小;(NH4)2SO4含有两个NH4+,则(NH4)2SO4中NH4+浓度最大;NH4HSO4电离产生氢离子,NH4+水解受到抑制,CH3COONH4中醋酸根水解呈碱性,NH4+水解得到促进,则NH4HSO4中NH4+浓度大于CH3COONH4中NH4+浓度;故NH4+浓度由大到小的顺序为 ④>②>①>③;(2) 浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液,氯化铵为强酸弱碱盐,发生水解,促进水的电离,由水电离出的H+浓度最大;硫酸、醋酸抑制水的电离,酸溶液比较水电离产生的氢离子,可比较溶液中氢氧根的浓度,硫酸为强酸,全部电离,0.1 mol·L-1的硫酸中氢离子浓度为0.2mol·L-1,氢氧根浓度为5×10—14mol·L-1,醋酸为弱酸,0.1 mol·L-1醋酸溶液中氢离子浓度远小于0.1 mol·L-1,氢氧根浓度远大于1×10—13mol·L-1;氢氧化钠抑制水的电离,碱溶液比较水电离产生的氢离子,可比较溶液中氢离子的浓度,0.1 mol·L-1氢氧化钠溶液中氢氧根浓度为0.1 mol·L-1,溶液中氢离子浓度为1×10—13mol·L-1;综上所述,四种溶液中由水电离出的H+浓度由大到小的顺序是④>②>③>①;(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,发生反应2Na+2H2O=2NaOH+H2↑,生成0.1mol氢氧化钠,再加蒸馏水稀释到1L,所得溶液中氢氧根浓度为0.1 mol·L-1,该温度下蒸馏水的pH=6,则水的离子积常数为1×10—12,则溶液中氢离子浓度为1×10—11mol·L-1,pH=11。
考点:考查电解质溶液,涉及水的电离、盐类水解及PH计算。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案