题目内容
(9分)在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中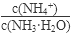 将
(填“增大”、“减小”或“不变”);
将
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因
,此时溶液中各离子浓度由大到小的顺序为 ;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1 V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式 。
【答案】
(1)增大(1分)
(2)小于(1分) NH4+ +H2O NH3·H2O+H+(2分)
NH3·H2O+H+(2分)
c(NH4+)>c(SO42- )>c(H+)>c(OH-)(2分)
(3)大于(1分) c(NH4+)+c(H+)=2c(SO42- )+c(OH-)(2分)
【解析】(1)氨水中存在电离平衡:NH3·H2O NH4+ +OH-。若向氨水中加入少量硫酸铵固体,则会增大c(NH4+),抑制电离,但平衡后c(NH4+)仍比原平衡大,故溶液中
NH4+ +OH-。若向氨水中加入少量硫酸铵固体,则会增大c(NH4+),抑制电离,但平衡后c(NH4+)仍比原平衡大,故溶液中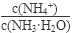 将增大。
将增大。
(2)pH=1的硫酸,其浓度是0.05mol·L-1。通过计算可知等体积混合二者恰好反应,生成硫酸铵,硫酸铵水解显酸性。方程式为NH4+ +H2O NH3·H2O+H+。
NH3·H2O+H+。
(3)由(2)可知等体积混合后溶液显酸性,所以要让溶液显中性,氨水必须过量,即氨水的体积大于硫酸的体积。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
 NH3?H2O+H+
NH3?H2O+H+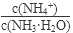 将
(填“增大”、“减小”或“不变”);
将
(填“增大”、“减小”或“不变”);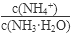 将
(填“增大”、“减小”或“不变”);
将
(填“增大”、“减小”或“不变”);